- Головна
- /
- Статті
- /
- Кардіологія
- /
- Артериальная гипертензия и патология почек
Артериальная гипертензия и патология почек
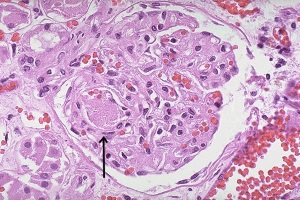
Существует тесная взаимосвязь между артериальной гипертензией и функциональным состоянием почек. Дефект функции почек, заключающийся в недостаточном выведении натрия и воды, считают важнейшим патогенетическим звеном эссенциальной гипертензии.
 Поражение почек вследствие артериальной гипертензии или, точнее, в результате патологических изменений в почечных артериях мелкого калибра называют первичным нефросклерозом, в отличие от вторичного нефросклероза, развивающегося вследствие заболеваний почек, таких как гломерулонефрит, поликистоз, обструктивные заболевания и др. В зарубежной литературе часто применяют термин «гипертензивная нефропатия», имеющий то же значение, что и «первичный нефросклероз».
Поражение почек вследствие артериальной гипертензии или, точнее, в результате патологических изменений в почечных артериях мелкого калибра называют первичным нефросклерозом, в отличие от вторичного нефросклероза, развивающегося вследствие заболеваний почек, таких как гломерулонефрит, поликистоз, обструктивные заболевания и др. В зарубежной литературе часто применяют термин «гипертензивная нефропатия», имеющий то же значение, что и «первичный нефросклероз».
Структурные изменения в почках, характерные для первичного нефросклероза, заключаются в развитии фиброза паренхимы, поражении сосудов (преимущественно прегломерулярных мелких артерий и артериол) в виде их гиалиноза, фиброплазии интимы, утолщения медии. В поздней стадии клубочки склерозируются, канальцы атрофируются. Почки уменьшаются в размерах, сморщиваются, их поверхность становится зернистой. Похожие, хотя и менее выраженные, изменения в почках происходят в процессе физиологического старения у людей с нормальным АД. Частота вовлечения почек в патологический процесс при АГ с развитием явных клинических проявлений, таких как протеинурия и/или повышение уровня креатинина, зависит от многих факторов – возраста, расы, наследственности, течения АГ («доброкачественное» или злокачественное), наличия или отсутствия терапии. Поражение почек является отличительной особенностью злокачественной гипертензии и значительно реже наблюдается при ее «доброкачественном» течении. Уремия – основная причина смерти больных со злокачественной АГ.
Сегодня некоторое представление о распространенности первичного нефросклероза дает статистика использования гемодиализа в промышленно развитых странах, где эта процедура доступна населению. В 1996 г. в США гемодиализ был проведен 290 тыс. больным, из которых 39% составили пациенты с хронической почечной недостаточностью (ХПН), обусловленной сахарным диабетом, 28% – больные с ХПН на фоне гипертензии, 13% – с ХПН вследствие гломерулонефрита, остальные 20% – с ХПН вследствие других причин. В странах Европы АГ является третьей по частоте причиной (после гломерулонефрита и диабета) поступления больных в центры гемодиализа. Наблюдается тенденция к неуклонному увеличению количества больных с ХПН вследствие АГ, особенно в США. Это связывают с влиянием нескольких факторов.
Первый фактор – существенное снижение смертности вследствие ИБС и инсультов в этой стране и в странах Европы в последнее десятилетие и увеличение продолжительности жизни, благодаря чему первичный нефросклероз (процесс, для которого характерно медленное прогрессирование), имеет достаточно времени, чтобы достичь своей финальной точки. Это мнение подтверждается тем, что рост количества случаев терминальной ХПН в США происходит за счет пожилых больных негроидной расы, в то время как среди чернокожих пациентов молодого и среднего возраста существенного увеличения заболеваемости не наблюдается.
Второй вероятный фактор – недостаточная эффективность антигипертензивной терапии. Поражение почек в виде нефросклероза – это необратимый процесс, неуклонно прогрессирующий и приводящий в итоге к полной утрате функции. Неизвестно, может ли антигипертензивная терапия вызвать ремиссию. Исследования, проведенные к настоящему времени, не дают ответа на этот вопрос, возможно, в связи с их малой продолжительностью (4-5 лет), недостаточной для того, чтобы оказать влияние на такой медленно текущий процесс, как первичный нефросклероз. Высказывается мнение, что одним только снижением АД невозможно предупредить прогрессирование первичного нефросклероза.
Считают, что даже мягкая и умеренная гипертензия может приводить к почечной недостаточности, хотя частота такого осложнения у белых людей очень низкая. Она значительно выше у лиц негроидной расы, которые предрасположены к гипертензивному поражению почек. ХПН, обусловленная АГ, регистрируется у них в 6 раз чаще, чем среди белых.
Взаимосвязь между АД и риском ХПН была сильнее и более постоянной для систолического АД, чем для диастолического. Полагают, что факторы, предрасполагающие к поражению почек у больных с АГ, следующие: высокий уровень АД, пожилой возраст, черная раса, наличие протеинурии, нарушение толерантности к глюкозе, курение.
Клинические маркеры поражения почек
Нет специфических клинических признаков, которые ясно указывали бы на наличие гипертензивной нефропатии (первичного нефросклероза).
Относительно ранними указаниями на вовлечение почек в патологический процесс при эссенциальной гипертензии являются: микроальбуминурия, повышение экскреции с мочой β2-микроглобулина, N-ацетилглюкозaминидазы, увеличение содержания мочевой кислоты в плазме крови.
По данным исследования MONICA, вероятность развития ИБС при наличии микроальбуминурии в 2,4 раза выше, чем при нормоальбуминурии. Значение микроальбуминурии при эссенциальной гипертензии до конца не ясно, однако полагают, что ее наличие указывает на начальное поражение почек и/или на риск прогрессирующего нарушения функции почек в будущем. Есть данные о том, что микроальбуминурия отражает нарушенную способность почек адекватно реагировать на избыточное поступление белка с пищей. Полагают также, что она является маркером дисфункции эндотелия почечных сосудов.
Экскреция β2-микроглобулина повышается преимущественно у больных с тяжелой гипертензией. Фермент N-ацетилглюкозaминидаза вырабатывается клетками почечных канальцев. Повышение его содержания в моче у больных с эссенциальной гипертензией указывает на вовлечение почек; антигипертензивная терапия уменьшает его уровень. Содержание мочевой кислоты повышено у 25% больных с нелеченной гипертензией; оно прямо коррелирует с сопротивлением почечных сосудов.
К поздним проявлениям патологии почек относят протеинурию и/или повышение содержания креатинина в плазме крови. Последний признак появляется при снижении скорости клубочковой фильтрации (СКФ) примерно вдвое по сравнению с нормой, т. е. тогда, когда потеряна половина функционирующих нефронов.
Диагноз поражения почек при гипертонической болезни устанавливают при наличии следующих критериев:
- длительное (более трех месяцев) снижение функции почек, проявляющееся уменьшением СКФ <60 мл/мин/1,73 м2;
- наличие альбуминурии >300 мг/сут или отношение содержания белка в одноразовой пробе мочи к содержанию в ней креатинина >200 мг/г в течение 3 месяцев или дольше.
Для оценки скорости клубочковой фильтрации в общеврачебной практике используют расчетный клиренс эндогенного креатинина (рКК), который можно вычислять по различным формулам. Наиболее широко используется формула Cockcroft-Gault (1976):
для мужчин рКК = (140 – возраст) х масса (кг) / 72 х креатинин сыворотки (мг/дл);
для женщин рКК = (140 – возраст) х масса (кг) х 0,85 / 72 х креатинин сыворотки (мг/дл).
Более точным, но и более сложным методом является оценка скорости клубочковой фильтрации путем сопоставления уровней эндогенного креатинина в крови и моче:
КК (мл/мин) = креатинин мочи (мг/дл) х объем мочи (мл/сут) / креатинин сыворотки (мг/дл) х 1,440.
Нормальные показатели клиренса креатинина для мужчин 20-50 лет составляют 97-137 мл/мин/1,73 м2, для женщин того же возраста – 88-128 мл/мин/1,73 м2. После 40 лет этот показатель уменьшается на 1% ежегодно.
Лечение больных с артериальной гипертензией и поражением почек
Повышение АД ускоряет прогрессирование дисфункции почек, а адекватная антигипертензивная терапия может замедлять ее и отдалять время наступления ХПН.
Помимо снижения АД, большое значение для предупреждения нефросклероза (как первичного, так и вторичного) имеет устранение внутриклубочковой гипертензии. Антигипертензивные препараты, способные уменьшать внутриклубочковую гипертензию, оказывают более существенное нефропротекторное действие, чем те, которые не влияют на внутрипочечную гемодинамику. По некоторым наблюдениям функция почек на фоне антигипертензивной терапии более стабильна у тех больных, у которых в первые дни лечения антигипертензивными средствами происходит снижение внутриклубочкового давления, что клинически проявляется преходящим уменьшением скорости клубочковой фильтрации.
Уменьшение протеинурии также оказывает ренопротекторное действие. Ухудшение функции почек происходит быстрее у больных с выраженной протеинурией. Напротив, ее уменьшение в начале антигипертензивной терапии является предиктором более благоприятного течения заболевания почек в дальнейшем. Эта закономерность не зависит от применяемого антигипертензивного препарата. Уменьшение протеинурии вследствие ограничения белка в диете также имеет ренопротекторный эффект. Снижение АД у таких больных оказывает дополнительное нефропротекторное действие.
Немедикаментозная терапия. Наиболее важным нефармакологическим подходом к лечению больных с нарушенной функцией почек является ограничение в диете соли. Это ограничение более существенное, чем то, которое рекомендуется при неосложненной гипертонической болезни: <2,4 г Na в сутки. Больному следует объяснить, что необходимо избегать употребления готовых продуктов, как правило, содержащих очень большое количество соли, добавление которой входит в технологию приготовления колбас, ветчины, консервированных овощей и супов, копченой рыбы, мясных и рыбных консервов.
Потребление соли должно быть индивидуализировано, так как ее избыточное ограничение может быть не менее опасным, чем высокое потребление. Гипонатриемия и ее следствие – гиповолемия – могут приводить к снижению почечного кровотока и развитию преренальной азотемии. Поэтому таким больным следует проводить регулярный контроль содержания креатинина в крови, особенно в период подбора ежедневного количества хлористого натрия в пище.
Лекарственное лечение. Фармакологические препараты назначают при неэффективности ограничения потребления соли. Лечение АГ у больных с заболеванием почек незначительно отличается от общепринятой терапии при повышенном АД. Все классы препаратов, обычно использующиеся для терапии артериальной гипертензии, приемлемы для таких больных. Однако после развития ХПН риск побочных эффектов становится особенно высоким. С одной стороны, это обусловлено накоплением препаратов в циркулирующей крови из-за нарушения их элиминации (в тех случаях, когда препарат выводится в основном почками). С другой стороны, антигипертензивная терапия может усугублять ХПН в связи с нефротоксическим или гемодинамическим действием препаратов: уменьшением объема циркулирующей крови, снижением АД, ухудшением почечной гемодинамики. Это диктует необходимость соблюдения особой осторожности при лечении таких больных.
Антигипертензивную терапию следует начинать с назначения малых доз и титровать их до достижения оптимального эффекта. При этом необходимо учитывать пути выведения препаратов: те из них, которые выводятся исключительно почками, следует назначать в меньших дозах, чем обычно. Исключение составляют калийсберегающие диуретики, которые не следует назначать при тяжелой почечной недостаточности, а при начальной ХПН дозы нужно уменьшить. Тиазидные диуретики и индапамид не назначают больным с тяжелой ХПН в связи с их неэффективностью. При лечении таких больных следует избегать также назначения резерпина, который может кумулировать и создавать высокую концентрацию в крови. Дозы β-адреноблокаторов, имеющих длительный период полувыведения (атенолол, ацебутолол, надолол, бетаксолол, соталол) должны быть уменьшены в 2-3 раза. Липофильные β-блокаторы с коротким периодом полувыведения (пропранолол, метопролол) могут применяться в обычных дозах. Ингибиторы АПФ каптоприл, эналаприл, лизиноприл, рамиприл, периндоприл выводятся преимущественно почками, поэтому требуется уменьшение их дозы на 50-75% в зависимости от препарата и выраженности ХПН.
Ингибиторы АПФ, которые элиминируются не только почками, но и печенью (моэксиприл, фозиноприл, трандолаприл), могут использоваться в обычных дозах, кроме случаев тяжелой ХПН, когда скорость клубочковой фильтрации снижена до 10 мл/мин и ниже. В соответствии с рекомендациями Европейского общества кардиологов (2004) увеличение содержания креатинина на 50% и более или повышение его уровня >265 ммоль/л требуют отмены терапии ингибиторами АПФ. Появление гиперкалиемии (содержание калия в плазме >6,0 ммоль/л) также является сигналом к их отмене.
Диуретики, по данным большинства экспериментальных и клинических исследований, не оказывают существенного нефропротекторного действия. Напротив, монотерапия диуретиками может ускорять снижение функции почек, несмотря на наличие антигипертензивного эффекта.Тем не менее при наличии ХПН диуретики являются необходимым компонентом терапии, направленной на устранение отеков и снижение АД. У больных с нарушенной функцией почек обычно увеличен объем внеклеточной жидкости, что клинически легко распознается по наличию периферических отеков, отечности вокруг глаз, застойных явлений в легких. В таких случаях диуретики – препараты выбора.
Больные с артериальной гипертензией, обусловленной паренхиматозными заболеваниями почек, менее чувствительны к тиазидным диуретикам, чем страдающие гипертонической болезнью. Тиазидные диуретики не эффективны при повышении содержания креатинина до 2,0 мг/дл (177 мкмоль/л) или при уменьшении клиренса креатинина ниже 30 мл/мин.
Препаратами выбора в этой клинической ситуации являются петлевые диуретики – фуросемид, торасемид, этакриновая кислота, буметанид. Они действуют путем подавления реабсорбции хлора и натрия в толстом восходящем колене петли Генле. Фуросемид выводится почками: 50% в неизмененном виде, 50% – в конъюгате с глюкуроновой кислотой (последний образуется в почках). У больных с почечной недостаточностью период полувыведения фуросемида увеличен из-за снижения экскреции с мочой и замедления конъюгации. Торасемид и буметанид метаболизируются не только в почках, но и в печени (80 и 50% соответственно), поэтому период их полувыведения у больных с почечной недостаточностью не увеличивается.
Все петлевые диуретики оказывают ототоксическое действие. Оно наиболее существенно при использовании этакриновой кислоты, в связи с чем ее применение ограничивают больным, которые не переносят других диуретиков из-за аллергических реакций.
Торасемид и буметанид почти полностью абсорбируются в желудочно-кишечном тракте (80-100%), что облегчает титрование дозы и определяет предсказуемость действия. Биодоступность фуросемида варьирует в значительных индивидуальных пределах (абсорбируется от 10 до 100% дозы, принятой внутрь), в связи с чем у конкретного больного трудно предвидеть его эффективную дозу.
Натрийуретический ответ зависит от дозы диуретика, достигшей места его действия в почечном канальце. Существует пороговая доза, необходимая для того, чтобы доставить к месту действия в нефроне то количество препарата, которое вызывает диуретический ответ. Кривая доза – эффект для петлевых диуретиков – имеет сигмоидальный характер. В связи с этим необходимо титровать дозу, чтобы определить количество препарата, соответствующее той точке на кривой, где незначительное увеличение дозы дает значительное увеличение диуреза, и использовать минимальную дозу, дающую максимальный эффект. Ее не следует превышать, так как дальнейшее увеличение количества диуретика не усиливает его действия. У здоровых людей внутривенное введение 40 мг фуросемида дает максимальный эффект в виде экскреции от 3 до 4 литров мочи в течение 3-4 часов.
Больным с почечной недостаточностью требуются большие дозы диуретиков. Так, при клиренсе креатинина 15 мл/мин в первичную мочу (канальцевую жидкость) поступает всего 10-20% петлевого диуретика в сравнении со здоровыми людьми. Максимальный натрийуретический ответ в этом случае наблюдается при внутривенном болюсном введении 160-200 мг фуросемида. Увеличение этой дозы не усиливает эффекта. Некоторым больным требуется вводить эту дозу несколько раз в сутки.
Длительное использование петлевых диуретиков может приводить к «ускользанию» эффекта. Это обусловлено появлением гипертрофии дистальных сегментов нефрона с одновременным увеличением реабсорбции натрия, который, минуя петлю Генле, начинает реабсорбироваться в более дистальных (гипертрофированных) участках, что приводит к снижению диуреза. Результатом становится толерантность к петлевым диуретикам. Тиазидные диуретики блокируют дистальные участки нефрона, что дает синергический эффект с петлевыми диуретиками. Этот феномен служит обоснованием для использования комбинации петлевых и тиазидных диуретиков у больных, не дающих адекватного ответа на оптимальные дозы петлевых диуретиков.
Биодоступность петлевых диуретиков у больных с ХПН по сравнению со здоровыми людьми не изменена. В связи с этим дозы торасемида и буметанида (препаратов с высокой биодоступностью) для внутривенного и внутреннего применения не отличаются. Биодоступность фуросемида ниже, поэтому его максимальная доза для приема внутрь в 2 раза выше внутривенной (160-320 мг у больных с умеренной ХПН и 320-480 мг – с тяжелой ХПН). В случае плохого ответа на высокие дозы петлевых диуретиков их можно вводить путем длительной внутривенной инфузии: если в месте действия диуретика постоянно поддерживается его достаточное количество, эффективность увеличивается.
Другой подход заключается в комбинировании петлевого диуретика с тиазидным (например, с гидрохлортиазидом). Больным с мягкой и умеренной ХПН требуется 50-100 мг гидрохлортиазида ежедневно, в более тяжелых случаях – 100-200 мг в сутки. Следует избегать избыточного диуреза – это чревато гиповолемией и усилением азотемии. Не рекомендуется назначать также калийсберегающие диуретики, которые способны вызывать гиперкалиемию. Необходимо ограничить потребление натрия, так как при проведении диуретической терапии в междозовые интервалы иногда наблюдается компенсаторная задержка натрия, что может полностью нейтрализовать натрийуретический эффект диуретиков. Этот феномен чаще всего наблюдается после обильного и быстрого диуреза вследствие приема препаратов с коротким периодом полувыведения (все петлевые диуретики, кроме торасемида). Вскоре после окончания действия такого диуретика может развиваться интенсивная реабсорбция натрия, продолжающаяся несколько часов. Преодолеть это явление помогает введение диуретика несколько раз в течение суток.
У больных с тяжелой артериальной гипертензией терапия диуретиками с точки зрения снижения АД часто неэффективна. В этих случаях используют их комбинацию с другими антигипертензивными препаратами, в первую очередь ингибиторами АПФ и антагонистами кальция.
Ингибиторы АПФ оказывают выраженное нефропротекторное действие у больных с заболеваниями почек и артериальной гипертензией. Оно проявляется уменьшением протеинурии и замедлением снижения скорости клубочковой фильтрации, а также более поздними морфологическими изменениями. Основной механизм защиты почек при лечении ингибиторами АПФ – снижение гидростатического давления в клубочках, обусловленное уменьшением тонуса эфферентной артериолы. Это предотвращает гиперфильтрацию белка и появление морфологических изменений, обусловленных внутриклубочковой гипертензией. Тонус афферентной артериолы также уменьшается, хотя и в меньшей степени, чем эфферентной. Благодаря дилатации приводящих сосудов почечный кровоток не ухудшается, несмотря на снижение системного АД.
Наряду с улучшением локальной (почечной) гемодинамики, ингибиторы АПФ, по мнению итальянских исследователей P. Ruggenenti и G. Remuzzi (1999), оказывают прямое действие на мембрану клубочковых капилляров. Оно заключается в снижении проницаемости мембраны для альбумина и других крупных молекул благодаря уменьшению размеров неселективных пор, имеющихся (предположительно) в базальной мембране. Это способствует улучшению селективной проницаемости мембраны и уменьшению протеинурии. Указанный эффект не зависит от градиента гидравлического давления в капиллярах и дополняет антипротеинурическое действие, обусловленное уменьшением указанного градиента на фоне терапии ингибиторами АПФ. Значение снижения экскреции белка с мочой определяется значимостью протеинурии как нефротоксического агента, вызывающего повреждение почечного интерстиция и прогрессирование нефросклероза. Следовательно, основные механизмы нефропротекторного действия ингибиторов АПФ – это:
- снижение системного АД;
- снижение давления в капиллярах клубочков;
- уменьшение проницаемости мембраны клубочков.
Клинические исследования больных с АГ и заболеваниями почек различного генеза подтверждают наличие существенного нефропротекторного действия ингибиторов АПФ. Метаанализ 10 продолжительных рандомизированных исследований, в которых приняли участие 1594 больных с поражением почек и АГ (без сахарного диабета), показал, что ингибиторы АПФ более эффективны в замедлении прогрессирования нефропатии, чем другие антигипертензивные средства: риск терминальной ХПН уменьшался при их применении на 30%. Однако уровень АД в группе больных, принимавших ингибиторы АПФ, оказался ниже (САД – на 4,9 мм рт. ст. и ДАД – на 1,2 мм рт. ст.), что затрудняет интерпретацию результатов этих исследований: благоприятное действие лечения на почки может быть обусловлено более существенным снижением АД, а не особенностями препаратов.
Ингибиторы АПФ наиболее эффективны у больных с протеинурией. На это указывают результаты исследования REIN (1997), проведенного у 352 больных с хроническими заболеваниями почек (с АГ и без нее) и с различной выраженностью протеинурии. Среди больных с экскрецией белка более 3 г/сут риск терминальной ХПН или двукратного увеличения содержания креатинина в крови при лечении ингибитором АПФ рамиприлом был в два раза ниже, чем на фоне антигипертензивной терапии, не включавшей ингибиторы АПФ. Экскреция белка при лечении рамиприлом уменьшалась более чем в 2 раза (на 55%). У больных с менее выраженной протеинурией (от 1 до 3 г/сут) нефропротекторное действие рамиприла было менее существенным. Оно проявлялось позже (через 5 лет после начала терапии), тогда как у больных с тяжелой протеинурией признаки замедления прогрессирования ХПН были очевидными уже на первом году лечения. Уровень АД на фоне терапии рамиприлом и другими препаратами не отличался. Больные с самой высокой экскрецией белка (>7 г/сут) отвечали на терапию рамиприлом наиболее выраженным нефропротекторным эффектом: диализ к концу исследования потребовался 20% из них, тогда как в группе больных, не принимавших рамиприл, – 70% больных.
Основные правила назначения ингибиторов АПФ больным с АГ и поражением почек.
- Начинать с низкой дозы, постепенно увеличивая ее до эффективной. Нефропротекторное действие усиливается с увеличением дозы.
- Тщательно мониторировать функцию почек (уровень креатинина, расчетный клиренс креатинина, при возможности – скорость клубочковой фильтрации).
Продолжение следует.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Лечение больных с артериальной гипертензией и ишемической болезнью сердца: новые возможности улучшения прогноза
Лечение больных с артериальной гипертензией и ишемической болезнью сердца: новые возможности улучшения прогноза
 Артериальная гипертензия у беременных
Артериальная гипертензия у беременных
 Роль ингибиторов АПФ в лечении артериальной гипертензии
Роль ингибиторов АПФ в лечении артериальной гипертензии
 Фармадипин в лечении гипертонических кризов у больных артериальной гипертензией
Фармадипин в лечении гипертонических кризов у больных артериальной гипертензией