- Головна
- /
- Статті
- /
- Травматологія і ортопедія
- /
- Диагностика и лечение реактивного артрита
Диагностика и лечение реактивного артрита
В настоящее время реактивный артрит (РеА) является одним из наиболее частых ревматологических диагнозов. Обычно реактивным считают артрит, который не удовлетворяет диагностическим критериям ревматоидного или подагрического артрита и не сопровождается специфической для системных ревматических заболеваний внесуставной симптоматикой. Реактивный артрит представляет собой группу заболеваний, которые характеризуются однотипным поражением опорно-двигательного аппарата.

Нозологическая сущность и эпидемиология
Будучи не самым тяжелым, но, безусловно, одним из наиболее распространенных ревматических заболеваний, РеА порождает неоднозначность мнений специалистов и существенные различия в подходах к его лечению. Поэтому освещение проблемы РеА целесообразно начать с определения его нозологической сущности.
Согласно Международной классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10, 1992), выделяют группу реактивных артропатий, при которых микробное инфицирование организма установлено, но в суставе не выявлены ни микроорганизмы, ни антигены.
Классификация реактивных артритов:
М02
Реактивные артропатии
М02.0
Артропатия, сопровождающая кишечный шунт
М02.1
Постдизентерийная артропатия
М02.2
Постиммунизационная артропатия
М02.3
Болезнь Рейтера
М02.8
Другие реактивные артропатии
М02.9
Реактивная артропатия неуточненная
В отношении данного раздела МКБ следует заметить:
- артропатия кишечного шунта и постдизентерийная артропатия встречаются редко, при этом клинические признаки поражения кишечника (или данные анамнеза) упрощают постановку диагноза;
- постиммунизационной артропатии присуща четкая хронологическая связь с предшествующей иммунизацией (введением сывороток, вакцин, g-глобулинов, интерферонов);
- выделение рубрик М02.8 и М02.9 (другие реактивные артропатии и неуточненные реактивные артропатии) являлось вполне оправданным на момент принятия МКБ-10, когда возможности лабораторной верификации этиологических агентов РеА были существенно меньшими, чем сегодня.
Таким образом, в случае, когда РеА не связан с кишечной инфекцией или предшествующей иммунизацией, его следует рассматривать как болезнь Рейтера. Последняя характеризуется как триада, состоящая из уретрита, артрита и конъюнктивита, с возможными поражениями кожи и слизистых, такими как бленноррагическая кератодерма, кольцевидный баланит, вульвит, увеит, изъязвления в полости рта, а также кардиологическими или неврологическими симптомами. Эта классическая триада, описанная в доантибиотическую эпоху, сегодня встречается крайне редко, артрит может быть единственным проявлением заболевания, которое вынуждает пациентов обращаться за медицинской помощью [3, 14]. Объективные признаки РеА присутствуют в 0,8-4% случаев инфекций нижних половых путей, таких как уретрит или цервицит. РеА в 10 раз чаще встречается у мужчин, чем у женщин, преимущественно в возрасте 20-40 лет [3, 9, 12, 14].
Этиология РеА неизвестна. Предположительно, в основе РеА лежит генетически детерминированная аномалия иммунной системы (заболевание в 50 раз чаще диагностируется у носителей антигена гистосовместимости HLA-B27), которая реализуется при инфицировании некоторыми микроорганизмами [10, 12].
Патогенетические механизмы РеА неизвестны, хотя очевидно вовлечение иммунного ответа на микроорганизмы урогенитального тракта. Полагают, что развитие иммунокомплексного синовита обусловлено чрезмерным иммунным ответом макроорганизма на микробные антигены, находящиеся вне полости сустава, с формированием иммунных комплексов, которые откладываются в синовиальной оболочке [10, 13].
Роль хламидийной урогенитальной инфекции в развитии РеА. РеА чаще всего ассоциирован с хламидийной (Chlamydia trachomatis) урогенитальной инфекцией [6, 10].
Ureaplasma urealyticum встречается нечасто и только в редких случаях может быть причиной РеА.
Причинная роль других патогенов и комменсалов половых путей возможна, но для ее оценки в настоящее время не имеется достаточного количества данных [6, 10].
Урогенитальная инфекция, вызываемая микроорганизмом Chlamydia trachomatis (серотипы D, K), – наиболее распространенная в европейских странах бактериальная инфекция, передающаяся половым путем, встречающаяся как у мужчин, так и у женщин. Бессимптомная инфекция особенно характерна для женщин (до 80% случаев) и часто остается нераспознанной, приводя к заражению половых партнеров и отдаленным неблагоприятным последствиям [9, 10, 12, 14].
Хламидии – облигатные внутриклеточные паразиты, способные латентно персистировать в организме, поражая эпителиальные, гладкомышечные клетки и макрофаги. Хламидии характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм – культивируемых элементарных (ЭТ) и некультивируемых ретикулярных телец (РТ). Первые – метаболически неактивны, расположены внеклеточно и устойчивы к воздействию антибактериальных препаратов, их поглощение клеткой происходит путем эндоцитоза. На этой стадии ЭТ находятся внутри цитоплазматических включений – эндосом, транспортируемых в дистальные участки аппарата Гольджи, где эндосомой поглощаются необходимые для метаболизма и репликации хламидии субстанции.
После поглощения ЭТ увеличиваются и превращаются в активно делящиеся РТ. Формируется хламидийное включение – колония размером 0,6-1,5 мкм, насчитывающая до 1000 микроорганизмов (рис. 1). Встраивающиеся в мембрану эндосомы белки, секретируемые РТ, препятствуют их слиянию с лизосомами. Через 18-48 ч РТ вновь уплотняются. Часть из них покидают клетку, инфицируя соседние и продолжая 40-72-часовой цикл развития. Выход хламидий из эпителиальной клетки не всегда сопровождается гибелью последней, более того, для инфицированных клеток характерна усиленная пролиферация. Важную роль в процессе выживания микроорганизма играет подавление экспрессии белков главного комплекса гистосовместимости II класса. Благодаря этому эпителиальная клетка не распознается как инфицированная иммунной системой [1, 5, 8].
Действие на хламидию антибактериального препарата ведет к прекращению конденсации РТ в ЭТ. Следствием влияния антибиотиков, особенно β-лактамов, является образование не делящихся, но жизнеспособных персистирующих телец. Их особенностью является резкое снижение метаболизма, определяющее устойчивость к антибактериальным препаратам. Для персистентов характерна слабая экспрессия главного белка наружной мембраны – ключевого антигена, стимулирующего иммунный ответ. Как следствие – у лиц с предрасполагающим генотипом возможно развитие аутоиммунной реакции, в частности синдрома Рейтера [1, 11, 15, 16].
Помимо фенотипической устойчивости у хламидии выявлена устойчивость, связанная с мутацией генов. В настоящее время описаны макролидустойчивые (устойчивые ко всем макролидам) и множественноустойчивые штаммы C. trachomatis. Показано, что если микроорганизм имеет моноаллельное расположение генов резистентности, прекращение воздействия антибиотика ведет к быстрой реверсии мутантного генотипа к дикому состоянию. Следует отметить, что генотипическая резистентность встречается реже, чем фенотипическая, и также способствует неэффективности терапии и персистенции хламидий [7, 11].
Клиническая картина РеА может включать:
- характерный суставной синдром;
- клинику урогенитальной инфекции;
- внесуставные поражения (кожи и слизистых оболочек);
- поражения позвоночника (обычно сакроилеит);
- висцеральные поражения;
- системную воспалительную реакцию [3, 10, 14].
Суставной синдром (обязательное проявление заболевания) характеризуется:
- асимметричным олигоартритом (воспалением 2-3 суставов или суставных групп) с поражением суставов ног (коленных, голеностопных, плюснефаланговых и межфаланговых) и тендовагинитом (ахиллобурситом);
- началом первого эпизода артрита в период до 30 дней после полового контакта, со средним интервалом в 14 дней между появлением урогенитальных симптомов и артритом;
- болью и ригидностью с отеком или без него в области прикрепления мышц, сухожилий и связок, особенно ахиллова сухожилия и плантарной фасции, к пяточной кости, что часто ведет к затруднениям при ходьбе [14].
Клинические признаки артрита [2]:
- Боль в суставе/суставах:
- ощущается во всем суставе;
- связана с движениями и суточным ритмом (при любых движениях, усиливается в покое и ночью);
- сопряжена с амплитудой движений в суставе (при движениях во всех плоскостях, нарастающая с увеличением амплитуды движений);
- обычно тупая, ноющая, выкручивающая.
- Скованность – субъективное ощущение препятствия движению, которое, как правило, наиболее выражено сразу после пробуждения, периода отдыха или неактивности. Скованность обусловлена нарушением оттока жидкости из воспаленного сустава в покое, уменьшается или проходит при возобновлении движений в суставе. Продолжительность и выраженность скованности отражают степень местного воспаления.
- Припухлость – преходящее увеличение в размерах и изменение контура сустава, обусловленные как накоплением экссудата в полости сустава, так и отеком периартикулярных тканей. Наиболее отчетливо припухлость выявляется на разгибательных (тыльных) поверхностях локтевых и лучезапястных суставов, на кисти, коленных и голеностопных суставах и стопе.
- Повышение температуры суставов также является признаком воспаления. Определяется проведением тыльной стороной ладони по поверхности сустава.
- Болезненность сустава при пальпации подтверждает, что боль в суставе обусловлена именно его поражением, а не является отраженной.
Рентгенологические признаки артрита на ранней стадии:
околосуставный остеопороз (основной признак), периартикулярный отек мягких тканей, возможно расширение суставной щели (в мелких суставах) (рис. 2).
Клиника урогенитальной инфекции
Признаки и симптомы урогенитальной инфекции обусловлены главным образом цервицитом и уретритом, а также их осложнениями.
У женщин симптомами урогенитальной инфекции примерно в 30% случаев являются:
- слизисто-гнойный цервицит;
- гнойные выделения из влагалища;
- боль в нижней части живота;
- посткоитальное или межменструальное кровотечение;
- дизурия;
- признаки воспалительного заболевания органов малого таза, хроническая боль в области органов малого таза.
У мужчин примерно в 75% случаев урогенитальная инфекция сопровождается следующими симптомами:
- выделениями из уретры;
- дизурией;
- признаками эпидидимита или простатита.
Симптомы, характерные как для мужчин, так и для женщин:
- аноректальные выделения и дискомфорт;
- конъюнктивит.
Внесуставные поражения
- Раздражение глаз с краснотой или без нее, фотофобия или ослабление зрительной активности (конъюнктивит) имеют место у 20-25% больных с РеА, ирит менее распространен и выявляется только у 2-11% пациентов. Редко могут наблюдаться изъязвления роговицы и кератит, описаны оптический неврит и задний увеит.
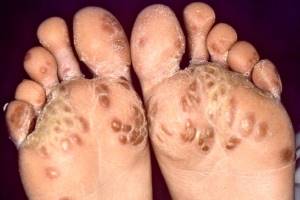
- Псориазиформные высыпания в виде типичных бляшек или каплевидный псориаз отмечаются у 12,5% больных; дистрофия ногтей – у 6-12%; типичные псориатические очаги на половых органах (кольцевидный баланит или вульвит) – у 14-40%; географический язык – примерно у 16%; пустулезный псориаз на подошвах стоп (кератодерма бленноррагическая) – у 33%. Последняя иногда встречается на ладонях рук. Стоматит и изъязвления полости рта выявляются примерно у 10% пациентов.
Поражения позвоночника
Боль в нижней части спины и ригидность типичны для дебюта заболевания, признаки сакроилеита (положительные симптомы Кушелевского) наблюдаются у 10% пациентов (рис. 3). При этом рентгенологические признаки одностороннего сакроилеита выявляются примерно у половины больных.
Висцеральные поражения
- Патология почек (протеинурия, микрогематурия и асептическая лейкоцитурия) наблюдается в 50% случаев и обычно бессимптомна. Гломерулонефрит и IgA-нефропатия встречаются редко.
- Ишемические очаги в сердце почти всегда бессимптомны, возможны тахикардия и изредка перикардит, а также поражение аортального клапана. Нарушения ЭКГ, в том числе задержка проводимости, регистрируются у 5-14% пациентов.
- Редкие проявления включают поражения нервной системы (менингоэнцефалит и периферические параличи).
Системная воспалительная реакция
Системные симптомы недомогания, усталости, потеря веса и лихорадка встречаются примерно у 10% пациентов. Практические у всех больных в клиническом анализе крови повышена скорость оседания эритроцитов (СОЭ).
Возможные клинические проявления РеА представлены на рисунке 4.
Клиническое течение и прогноз
- У большинства лиц болезнь носит самоограничивающийся характер со средней продолжительностью первого эпизода артрита 4-6 мес. Осложнения РеА возникают главным образом вследствие агрессивного артрита и наиболее вероятны, если пациент имеет ген HLA-B27.
- Примерно у 50% больных наблюдаются рецидивы артрита через различные интервалы времени.
- Хронификация заболевания с персистированием симптомов в течение более одного года отмечается примерно у 17% пациентов.
- Эрозивное поражение суставов особенно характерно для малых суставов стопы. Примерно у 12% больных развиваются деформации стопы, однако тяжелая деформация встречается редко [10, 14].
- При отсутствии лечения или рецидивирующем характере острый передний увеит может привести к быстрому образованию катаракты.
Диагностические исследования при РеА:
- клинический анализ крови (выявление повышения СОЭ);
- клинический анализ мочи (определение патологии почек и уретрита);
- исследование первой порции мочи (для подтверждения уретрита);
- культуральный урогенитальный тест (выявление этиологического агента);
- функциональные тесты почек и печени;
- выявление НLA-B27;
- рентген пораженных и крестцово-подвздошных суставов;
- ЭКГ;
- эхокардиограмма;
- офтальмологический осмотр (при поражении глаз);
- тесты на исключение других ревматических болезней (определение ревматоидного фактора [ревматоидный артрит] и мочевой кислоты в сыворотке крови [подагра]) [10].
Диагностика РеА основывается на следующих критериях:
- Типичное поражение суставов (периферическое, асимметричное, олигоартикулярное, нижних конечностей, особенно коленных и голеностопных суставов).
- Верификация возбудителя:
- во входных воротах (соскоб из уретры);
- специфические антитела в крови в достоверных титрах;
- субстрат возбудителя посредством полимеразной цепной реакции или специфических моноклональных антител.
- Наличие HLA-B27 антигена.
- Типичный анамнез (уретрит) и/или клинические проявления урогенитальной инфекции.
Для постановки окончательного диагноза РеА достаточно наличия первых двух критериев, критерии 3 и 4 являются вспомогательными [10].
Дифференциальная диагностика РеА с наиболее распространенными артритами на ранней стадии заболевания представлена в таблице.
Лечение РеА проводится по двум направлениям:
- Антибактериальная терапия.
- Терапия суставного синдрома.
Антибактериальная терапия РеА [10]:
- Продолжительность лечения составляет 7 дней.
- Больные хламидийной инфекцией должны быть обследованы на наличие других инфекций, передающихся половым путем.
- Рекомендуется воздерживаться от половых контактов в течение 7 дней после завершения 7-дневного курса лечения, а также до тех пор, пока все половые партнеры пациента не пройдут соответствующий курс лечения.
Рекомендованные схемы:
- Азитромицин в дозе 1,0 г перорально однократно (эффективная концентрация препарата в крови и тканях сохраняется 7-10 сут) или
- Доксициклин по 100 мг перорально 2 раза в день в течение 7 сут
Альтернативные схемы (эквивалентные):
- Эритромицин по 500 мг перорально 4 раза в день в течение 7 сут, или
- Офлоксацин по 200 мг перорально 2 раза в день на протяжении 7 сут, или
- Рокситромицин по 150 мг перорально 2 раза в день в течение 7 сут, или
- Кларитромицин по 250 мг перорально 2 раза в день на протяжении 7 сут
Дополнительные препараты:
- Амоксициллин по 500 мг перорально 3 раза в день в течение 7 сут или
- Джозамицин по 750 мг перорально 2 раза в день на протяжении 7 сут
Эритромицин менее эффективен, чем азитромицин или доксициклин, а его побочные действия на желудочно-кишечный тракт часто вынуждают пациентов отказываться от такой схемы лечения.
Рокситромицин и кларитромицин являются альтернативными макролидными антибиотиками с высокой концентрацией в тканях и переносятся пациентами лучше, так как более благоприятны с точки зрения побочных действий.
Офлоксацин сходен по эффективности с доксициклином и азитромицином, но более дорогостоящий и не имеет преимущества в дозировке. Другие хинолоны недостаточно эффективны против хламидийной инфекции.
Доксициклин и офлоксацин противопоказаны беременным женщинам.
Джозамицин в Украине назначают относительно редко (соответственно, меньше вероятность нечувствительности микробного агента к препарату).
Джозамицин и амоксициллин можно назначать беременным.
Ни одна из приведенных схем не является высокоэффективной, поэтому рекомендуется повторное лабораторное тестирование через 3 нед после завершения терапии. При положительных результатах тестирования или возобновлении урогенитальной симптоматики – повторный курс лечения со сменой антибиотика [4, 10].
Терапия суставного синдрома
Вопрос о том, влияет ли краткосрочный курс лечения антибиотиками острой урогенитальной инфекции на течение артрита при РеА, остается противоречивым [10]. Долгосрочная (3 месяца) антибактериальная терапия не оказывает влияние на течение артрита [10]. Поэтому лечение суставного синдрома при РеА проводится нестероидными противовоспалительными препаратами (НПВП), глюкокортикоидами (ГКК), а также базисными средствами [10, 14].
Выбор препаратов и доз диктуется степенью воспалительной активности заболевания.
При умеренном болевом синдроме, отсутствии системной воспалительной реакции (общего недомогания, усталости, потери веса и лихорадки), умеренном повышении СОЭ (в пределах 30 мм/ч) назначают НПВП и локальные введения ГКК. Определенного препарата выбора не существует, целесообразно дополнительное применение топических средств, содержащих НПВП. При воспалении коленного или голеностопного суставов возможны внутрисуставные введения ГКК. Для внутрисуставного введения предпочтительны наиболее мощные ГКК, такие как дексаметазон или комбинированный препарат бетаметазона пролонгированного действия Дипроспан. В зависимости от размеров и степени воспаления в сустав вводят 1-2 мл этих средств. При ахиллобурсите показана инъекционная (подкожная) инфильтрация пяточной области ГКК. При воспалении мелких суставов стопы эффективна аппликация димексида с дексаметазоном.
При выраженном болевом синдроме, наличии системной воспалительной реакции и значительном повышении СОЭ (> 30 мм/ч) вместо НПВП системно назначают ГКК, препаратами выбора являются метилпреднизолон и бетаметазон. Данные средства принимают в дозе 40-60 мг/сут преднизолонового эквивалента, разделенной на 2 приема (утренний и дневной), в течение 5-7 дней, с последующим ее снижением до отмены препарата по мере устранения местных и общих воспалительных проявлений. На фоне системного приема ГКК проводится их локальное применение по показаниям.
Одновременно с системным использованием ГКК назначают базисный препарат. Исторически для лечения РеА применяли сульфасалазин, соли золота, Д-пеницилламин и азатиоприн. В настоящее время наиболее подходящим базисным препаратом в терапии РеА следует считать метотрексат. Преимуществами метотрексата перед другими базисными средствами являются:
- быстрое развитие максимального терапевтического эффекта (4-12 нед с момента назначения);
- выраженное противовоспалительное действие;
- прогнозируемость наиболее частых (гематологических) из наиболее серьезных побочных эффектов;
- возможность выявления побочных эффектов на доклинической стадии при адекватном лабораторном мониторинге пациента;
- минимальная стоимость лечения (метотрексат наиболее недорогостоящий из всех базисных препаратов).
Метотрексат назначают в дозе 7,5-25 мг/нед. Препарат принимают по 2,5 мг с интервалом 12 ч за 30-40 мин до еды (при приеме на полный желудок возможна тошнота). Таким образом, если пациенту назначена доза 20 мг/нед, то, начиная прием в понедельник утром, он завершает его в четверг вечером. Затем следует перерыв по воскресенье включительно, и в следующий понедельник прием метотрексата возобновляется. Чем выше недельная доза метотрексата, тем быстрее развивается максимальный терапевтический эффект. При плохой переносимости перорального приема препарата (тошноте) метотрексат вводят подкожно (всю недельную дозу однократно).
Продолжительность применения метотрексата при РеА определяется течением заболевания. Если на протяжении года лечения метотрексатом не возникало рецидивов артрита, то прием препарата можно прекращать. При этом пациент пожизненно остается под наблюдением ревматолога, поскольку нельзя исключить рецидива заболевания в случае повторного урогенитального инфицирования.
Литература
- Гучев И.А. Хламидийные инфекции. Возможности антибактериальной терапии // РМЖ. – 2004. – Т. 13. – № 8. – С. 57-63.
- Доэрти М., Доэрти Д. Клиническая диагностика болезней суставов. – Минск: Тивали, 1993. – 321 с.
- Мерта Дж. Справочник врача общей практики: Пер. с англ. – М.: «Практика»-McGraw-Hill, 1999. – 459 с.
- Jang D., Sellors J., Howard M. et al. Correlation between culture testing of swabs and ligase chain reaction of first void urine from patients recently treated for Chlamydia trachomatis. Sex Transm Infect 2003; 79: 237-9.
- Kinnunen A., Molander P., Morrison R. et al. Chlamydial heat shock protein 60-specific T cells in inflamed salpingeal tissue. Fertil Steril 2002; 77: 162-6.
- Lyss S.B., Kamb M.L., Peterman T.A. et al. Chlamydia trachomatis among patients infected with and treated for Neisseria gonorrhoeae in sexually transmitted disease clinics in the United States. Ann Intern Med 2003; 139: 178-85.
- Misyurina O.Y., Chipitsyna E.V., Finashutina Y.P. et al. Mutations in a 23S rRNA gene of Chlamydia trachomatis associated with resistance to macrolides. Antimicrob Agents Chemother 2004; 48 (4): 1347-9.
- Morrison S.G., Morrison R.P. Resolution of secondary Chlamydia trachomatis genital tract infection in immune mice with depletion of both CD4+ and CD8+ T cells. Infect Immun 2001; 69 (4): 2643-9.
- Rich E., Hook III E.W., Alarcon G.S., Moreland L.W. Reactive arthritis in patients attending an urban sexually transmitted diseases clinic. Arthr Rheum 1996; 39: 1172-7.
- Sexually transmitted diseases treatment guidelines 2002. Centers for Disease Control and Prevention. MMWR Recomm Rep 2002; 51 (RR-6): 1-78.
- Somani J., Bhullar V.B., Workowski K.A. et al. Multiple drug-resistant Chlamydia trachomatis associated with clinical treatment failure. J Infect Dis 2000; 181: 1421-7.
- Stamm W.E., Holmes K.K. Chlamydia trachomatis infections in adults. In Holmes K.K., Mardh P.A., Sparling P.F., Weisner P.J. eds. Sexually Transmitted Diseases. New York: McGraw Hill International, 1999.
- Stephens R.S., Kalman S., Lammel C. et al. Genome sequence of an obligate intracellular pathogen of humans: Chlamydia trachomatis. Science 1998; 282: 754-9.
- Toivanen A. Reactive arthritis and Reiter's syndrome: history and clinical features. In: Klippel J.H., Dieppe P.A. eds. Rheumatology Vol. 2 (6:11), 2nd Edn. London: Mosby, 1998: 1-8.
- Whittington W.L., Kent C., Kissinger P. et al. Determinants of persistent and recurrent Chlamydia trachomatis infection in young women: results of a multicenter cohort study. Sex Transm Dis 2001; 28: 117-23.
- Wyrick P.B., Knight S.T. Pre-exposure of infected human endometrial epithelial cells to penicillin in vitro renders Chlamydia trachomatis refractory to azithromycin. J Antimicrob Chemother 2004; 54 (1): 79-85.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Клинические особенности течения реактивного артрита у больных с хроническим вирусным гепатитом
Клинические особенности течения реактивного артрита у больных с хроническим вирусным гепатитом
 Современные подходы к лечению ревматоидного артрита (укр)
Современные подходы к лечению ревматоидного артрита (укр)
 Ревматоїдний артрит і системний червоний вовчак як незалежні фактори ризику атеросклерозу
Ревматоїдний артрит і системний червоний вовчак як незалежні фактори ризику атеросклерозу
 К вопросу о связи инфекции с атеросклерозом
К вопросу о связи инфекции с атеросклерозом