Антифосфолипидный синдром (синдром Hughes) в практике детского врача
Проблема тромбофилии весьма актуальна для врачей различных специальностей как взрослой, так и детской практики. Одним из наиболее ярких и прогностически опасных состояний, проявляющихся рецидивирующими тромбозами, является антифосфолипидный синдром (АФС), в основе которого лежит формирование антифосфолипидных антител (аФЛ-АТ) – гетерогенных антител (АТ) к содержащимся в плазме отрицательно заряженным мембранным фосфолипидам.
Низкая концентрация аФЛ-АТ может обнаруживаться и у здоровых людей (естественные АТ), однако при повышении их содержания происходит развитие самостоятельного клинического синдрома. Прикрепляясь к стенкам сосудов, тромбоцитам, непосредственно вступая в реакции свертывания крови, аФЛ-АТ приводят к развитию тромбозов.
Изучение аФЛ-АТ началось еще в 1906 г., когда Вассерманом был разработан серологический метод диагностики сифилиса (реакция Вассермана – RW). В начале 40-х годов ХХ века установлено, что основным компонентом, с которым реагируют АТ (реагины) в реакции Вассермана, является отрицательно заряженный фосфолипид – кардиолипин. Через 10 лет в сыворотке крови больных системной красной волчанкой (СКВ) обнаружили ингибитор свертывания крови, который был назван волчаночным антикоагулянтом (ВА). Вскоре было установлено, что при СКВ продукция ВА сопровождается не кровоточивостью, а парадоксальным повышением частоты развития тромбозов. Разработка методов радиоиммунологического и иммуноферментного анализов позволила определять АТ к кардиолипину (аКЛ) и изучать роль аФЛ-АТ при различных заболеваниях. Оказалось, что аФЛ-АТ являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, привычное невынашивание беременности, другие формы акушерской патологии, тромбоцитопению и неврологические, кожные, сердечно-сосудистые, гематологические нарушения. В 1986 г. G.R.V. Hughes и соавт. [10] назвали этот симптомокомплекс антифосфолипидным синдромом, а спустя 8 лет на VI Международном симпозиуме по аФЛ-АТ предложено именовать АФС синдромом Hughes по имени английского ревматолога, впервые описавшего его и внесшего наибольший вклад в разработку этого вопроса.
Эпидемиология
Распространенность АФС в популяции неизвестна, аКЛ выявляются в сыворотке у 2-4% населения [6]. Иногда аФЛ-АТ обнаруживаются при воспалительных, аутоиммунных и инфекционных заболеваниях (сифилисе, болезни Лайма, ВИЧ-инфекции, гепатите С и др.), злокачественных опухолях (парапротеинемических гемобластозах, лимфолейкозах), при длительном приеме ряда медикаментов (оральных контрацептивов, психотропных средств и пр.). Заболевание развивается преимущественно в молодом возрасте, описано у детей и даже у новорожденных [7]. АФС чаще выявляется у женщин. Клинически АФС проявляется у 30% больных с ВА и у 30-50% пациентов, имеющих умеренный или высокий уровень аКЛ-IgG. Антифосфолипидные антитела обнаруживают у 21% лиц молодого возраста, перенесших инфаркт миокарда, и у 18-46% перенесших инсульт, у 12-15% женщин с рецидивирующими спонтанными абортами, у 1/3 больных СКВ. При наличии аФЛ-АТ на фоне СКВ риск развития тромбозов составляет 60-70%, при их отсутствии – 10-15%.
Этиология и патогенез
Причины АФС неизвестны. Повышение уровня аФЛ-АТ (как правило, транзиторное) наблюдается на фоне широкого спектра бактериальных и вирусных инфекций, но тромбозы в этих случаях развиваются редко, что объясняется различиями иммунологических свойств аФЛ-АТ при АФС и инфекциях. Тем не менее, предполагают, что развитие тромботических осложнений в рамках АФС может быть связано с латентной инфекцией [6, 7]. Отмечено повышение частоты обнаружения аФЛ-АТ в семьях больных АФС, описаны случаи АФС (чаще первичного) у членов одной семьи и определенная связь между гиперпродукцией аФЛ-АТ и носительством некоторых антигенов главного комплекса гистосовместимости, а также генетическими дефектами комплемента.
Антифосфолипидные антитела – гетерогенная группа АТ, реагирующих с широким спектром фосфолипидов и фосфолипидсвязывающих белков. К аФЛ-АТ относятся аКЛ, АТ к фосфатидилсерину, фосфатидилэтаноламину, β2-гликопротеин (ГП)-1-кофакторзависимые АТ, аннексин-V-зависимые АТ, АТ к протромбину, АТ к волчаночному антикоагулянту. ВА достаточно неоднороден, его обнаруживают не только при СКВ. Он вызывает удлинение активированного парциального тромбопластинового времени (АПТВ) in vitro, но in vivo инициирует гиперкоагуляцию и тромбозы [7].
Взаимодействие аФЛ-АТ с фосфолипидами представляет собой сложный процесс, в реализации которого важную роль играют так называемые кофакторы. Установлено, что аКЛ связываются с кардиолипином в присутствии аКЛ-кофактора, являющегося β2-ГП-1, циркулирующим в нормальной плазме в ассоциации с липопротеинами (он также обозначается как аполипопротеин Н) [1, 3]. β2-ГП-1 обладает естественной антикоагулянтной активностью. АТ, присутствующие в сыворотке больных АФС, на самом деле распознают антигенные детерминанты не анионных фосфолипидов (кардиолипин), а конформационные эпитопы (неоантиген), формирующиеся в процессе взаимодействия β2-ГП-1 с фосфолипидами. Напротив, при инфекционных заболеваниях присутствуют главным образом АТ, реагирующие с фосфолипидами в отсутствие β2-ГП-1.
Антифосфолипидные антитела способны перекрестно реагировать с компонентами эндотелия, включая фосфатидилсерин (анионный фосфолипид) и другие отрицательно заряженные молекулы (гепарансульфат протеогликана, хондроэтинсульфатный компонент тромбомодулина). Они подавляют синтез простациклина клетками эндотелия, стимулируют синтез фактора Виллебранда, индуцируют активность тканевого фактора эндотелиальными клетками, стимулируют прокоагулянтную активность, ингибируют гепаринзависимую активацию антитромбина-III и гепарин-опосредованное образование антитромбин-III-тромбинового комплекса, усиливают синтез фактора активации тромбоцитов клетками эндотелия. Предполагается, что особенно важную роль в процессе взаимодействия аФЛ-АТ и клеток эндотелия играет β2-ГП-1. β2-ГП-1-зависимое связывание аФЛ-АТ и интимой сосудов приводит к активации клеток эндотелия (гиперэкспрессии клеточных молекул адгезии, увеличению прилипания моноцитов к клеткам эндотелия), индуцирует их апоптоз, что в свою очередь увеличивает прокоагулянтную активность эндотелия. Мишенью для аФЛ-АТ могут являться и белки, регулирующие коагуляционный каскад, – белки С, S и тромбомодулин, экспрессирующиеся на мембране клеток эндотелия [1, 3, 4].
Провоцировать запуск каскада иммунных реакций, приводящих к формированию тромбозов при АФС, могут разнообразные триггеры (табл. 1).
Клинические проявления
В основе АФС лежит невоспалительная тромботическая васкулопатия с поражением сосудов любого калибра и локализации, в связи с чем спектр клинической симптоматики чрезвычайно разнообразен. В рамках АФС описаны патология центральной нервной системы (ЦНС), сердечно-сосудистой системы, нарушение функции почек, печени, эндокринных органов, желудочно-кишечного тракта (ЖКТ). С тромбозом сосудов плаценты связывают развитие некоторых форм акушерской патологии (см. «Предварительные классификационные критерии АФС»). Характерной особенностью АФС является частое рецидивирование тромбозов. Примечательно, что если первым проявлением АФС был артериальный тромбоз, то в последующем у большинства больных наблюдались артериальные тромбозы, а у пациентов с первым венозным тромбозом – венозные. Венозный тромбоз – наиболее частое проявление АФС. Тромбы обычно локализуются в глубоких венах нижних конечностей, а также в печеночных, портальных, поверхностных и других венах. Характерны повторные эмболии из глубоких вен нижних конечностей в легкие, иногда приводящие к легочной гипертензии.
При тромбозе симптомы чаще появляются незаметно, исподволь, нарушение функции органа нарастает постепенно, имитируя какое-либо хроническое заболевание (цирроз печени и др.). Закупорка сосуда оторвавшимся тромбом, напротив, приводит к развитию «катастрофического» нарушения функций органа. Так, тромбоэмболия легочной артерии проявляется приступами удушья, болью в грудной клетке, кашлем, иногда кровохарканьем.
АФС (чаще первичный, чем вторичный) – вторая по частоте причина синдрома Бадда-Киари (облитерирующий флебит или тромбофлебит печеночных вен травматического, инфекционного генеза с гепатомегалией, реже спленомегалией, асцитом, нарастающей гепатоцеллюлярной недостаточностью, иногда гипохолестеринемией, гипогликемией) [6]. Тромбоз центральной вены надпочечников часто ведет к их недостаточности. Тромбоз внутримозговых артерий, приводящий к инсульту и транзиторным ишемическим атакам, – наиболее частая локализация артериального тромбоза при АФС. Рецидивирующие ишемические микроинсульты иногда протекают без ярких неврологических нарушений и могут манифестировать судорогами, мультиинфарктной деменцией (напоминающей болезнь Альцгеймера), психическими нарушениями.
Вариантом АФС является синдром Снеддона (рецидивирующие тромбозы мозговых сосудов, сетчатое ливедо, артериальная гипертензия) [2]. Описаны другие неврологические нарушения, в том числе мигренозная головная боль, эпилептиформные приступы, хорея, поперечный миелит, которые, однако, не всегда можно связать с сосудистым тромбозом. Иногда неврологические нарушения при АФС напоминают таковые при рассеянном склерозе.
Одним из частых кардиологических признаков АФС является поражение клапанов сердца от минимальных нарушений, выявляемых только при эхокардиографии (небольшая регургитация, утолщение створок клапанов), до тяжелых пороков сердца (стеноз или недостаточность митрального, реже аортального или трикуспидального клапанов). В ряде случаев быстро развивается тяжелое поражение клапанов с вегетацией, обусловленной тромботическими наслоениями, неотличимыми от инфекционного эндокардита. Вегетации на клапанах при сочетании с геморрагиями в подногтевое ложе и симптомом барабанных палочек затрудняют дифференциальную диагностику с инфекционным эндокардитом. Описано развитие сердечных тромбов, имитирующих миксому сердца. Тромбоз коронарных артерий считается одной из возможных локализаций артериального тромбоза, связанного с синтезом аФЛ-АТ. Другая форма коронарной патологии при АФС – острый или хронический рецидивирующий тромбоз мелких внутримиокардиальных коронарных сосудов, развивающийся в отсутствие признаков воспалительного поражения основных ветвей коронарных артерий. Полагают, что этот процесс может привести к патологии миокарда, напоминающей кардиомиопатию с признаками регионарного или общего нарушения сократимости миокарда и гипертрофией левого желудочка [4-6].
Распространенным осложнением АФС является артериальная гипертензия (АГ), которая может быть лабильной, часто сочетающейся с сетчатым ливедо и поражением церебральных артерий при синдроме Снеддона, или стабильной, злокачественной, с признаками гипертонической энцефалопатии. Развитие АГ при АФС может быть связано со многими причинами: тромбозом почечных сосудов, инфарктом почек, тромбозом брюшного отдела аорты (псевдокоарктацией) и интрагломерулярным тромбозом почек [3, 5, 9]. Отмечена связь между гиперпродукцией аФЛ-АТ и развитием фиброзно-мышечной дисплазии почечных артерий. Особого внимания в плане развития АГ требуют пациенты, имеющие высокое артериальное давление, особенно нижнее, часто меняющееся в течение дня.
Поражение почек при АФС обусловлено внутриклубочковым микротромбозом – почечной тромботической микроангиопатией, последующим развитием гломерулосклероза, ведущего к нарушению функции почек [9]. Поражение сосудов печени может привести к увеличению ее размеров, асциту, повышению концентрации печеночных ферментов в крови.
Редким осложнением АФС считается тромботическая легочная гипертензия, связанная как с рецидивирующими венозными эмболиями, так и с местным тромбозом сосудов легких. При первичной легочной гипертензии обнаружено повышение уровня аФЛ-АТ только у больных с веноокклюзионной болезнью и тромбированием легочных сосудов. Описано несколько случаев первичного АФС в виде альвеолярных геморрагий, легочного капиллярита и микрососудистого тромбоза вплоть до развития «шокового» легкого.
Одним из наиболее характерных признаков АФС является акушерская патология (частота – 80%): привычное невынашивание беременности, рецидивирующие спонтанные аборты, внутриутробная гибель плода, преэклампсия. Потеря плода может наступать в любые сроки беременности, но несколько чаще в I триместре, чем во II и III. Кроме того, синтез аФЛ-АТ ассоциирован и с поздним гестозом, преэклампсией, эклампсией, задержкой внутриутробного развития плода, преждевременными родами. У женщин с СКВ именно АФС вызывает прерывание беременности. Развитие тромбозов описано у новорожденных от матерей с АФС и, вероятно, связано с трансплацентарной передачей аФЛ-АТ [5, 8].
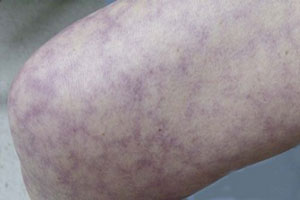
Поражение кожи при АФС характеризуется сетчатым ливедо (кружевной, тоненькой сеточкой сосудов на поверхности кожи, больше заметной на холоде), трудно поддающимися лечению язвами, псевдоваскулитными и васкулитными поражениями, периферической гангреной (некрозом кожи или отдельных пальцев рук или ног). Описано повышение уровня аФЛ-АТ при болезни Дего (очень редкой системной васкулопатии с распространенными тромбозами кожи, ЦНС и ЖКТ) [5, 7].
Типичным гематологическим признаком АФС является тромбоцитопения, чаще умеренная (70-100х106/л), которая не требует специального лечения. Развитие геморрагических осложнений отмечается редко и связано с дефектом специфических факторов свертывания крови, патологией почек или передозировкой антикоагулянтов. Часто наблюдается Кумбс-позитивная гемолитическая анемия, реже – синдром Эванса (сочетание тромбоцитопении и гемолитической анемии) [1, 7].
Лабораторные методы диагностики
Для определения уровня аФЛ-АТ в сыворотке крови используют:
- Кардиолипиновый тест методом иммуноферментного анализа – чаще используется; стандартизованный, но мало специфичный, бывает позитивным не только при АФС.
- Тест определения ВА методами, оценивающими свертываемость крови, – более специфичный, но менее чувствительный по сравнению с кардиолипиновым тестом.
- Ложноположительный RW-тест – малоспецифичный и чувствительный.
- Тест определения АТ к β2-ГП-1 – наиболее специфичный тест, может быть положительным при отсутствии аКЛ.
В практической деятельности чаще всего определяют аКЛ и ВА.
Клинические варианты АФС
Различают первичный и вторичный АФС. В случае отсутствия каких-либо признаков тех или иных заболеваний в течение не менее 5 лет с момента появления первого симптома АФС такой вариант считают первичным. Полагают, что около 50% больных страдают первичной формой АФС. Однако вопрос о нозологической самостоятельности первичного АФС до конца не ясен. Есть данные о том, что первичный АФС может быть вариантом начала СКВ. Наоборот, у некоторых больных с классической СКВ в дебюте в дальнейшем на первый план выходят признаки АФС. Дифференциальный диагноз первичного и вторичного АФС весьма затруднителен. Для первичного АФС не характерно наличие эритемы в виде бабочки, дискоидных высыпаний, фотодерматита, афтозного стоматита, артрита, серозита, синдрома Рейно, антинуклеарного фактора (АНФ) в высоком титре, АТ к нативной ДНК или Sm-антигену. При вторичном АФС чаще отмечаются гемолитическая анемия, тромбоцитопения, лимфопения, нейтропения и низкие уровни С4-компонента комплемента [7].
Выделяют следующие основные формы АФС:
- АФС у больных с достоверным диагнозом СКВ (вторичный АФС);
- АФС у больных с волчаночноподобными проявлениями;
- первичный АФС;
- «катастрофический» АФС (острая диссеминированная коагулопатия/васкулопатия с острым мультиорганным тромбозом, развивающимся за короткий промежуток времени (от нескольких часов до 7 дней) и приводящим к полиорганной недостаточности);
- другие микроангиопатические синдромы (тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром); HELLP-синдром (гемолиз, повышение уровня печеночных ферментов, снижение содержания тромбоцитов, беременность); ДВС-синдром; гипопротромбинемический синдром;
- серонегативный АФС.
«Катастрофический» АФС (КАФС) имеет наиболее тяжелый прогноз. У большинства пациентов с КАФС отмечается микроангиопатия с окклюзией мелких сосудов различных органов, преимущественно почек, легких, головного мозга, сердца и печени. У некоторых больных развивается тромбоз крупных сосудов. Нередко при КАФС тромбоз сочетается с тромбоцитопенией и/или гемолитической анемией [3, 5, 7].
Развитие КАФС отмечено у больных разного возраста, в том числе и у детей в возрасте до 15 лет. Он нередко возникает при первичном АФС, из ревматических заболеваний – наиболее часто при СКВ и лишь в отдельных случаях при других нозологиях. Следует подчеркнуть, что у 1/2-1/3 больных инициирующими КАФС факторами являются инфекции, что связано с феноменом молекулярной мимикрии между бактериальными антигенами и β2-ГП-1-аутоантигеном. Инициирующими факторами развития КАФС могут быть бактериальные токсины, хирургическое вмешательство, проведение инвазивного инструментального исследования, травмы, отмена антикоагулянтов, назначение ряда медикаментов (тиазидов, каптоприла, эстрогенсодержащих препаратов и др.). При вторичном АФС развитие КАФС может быть обусловлено обострением основного заболевания. Вместе с тем КАФС при СКВ обычно возникает внезапно на фоне умеренной активности заболевания, нередко у пациентов, находящихся на диспансерном мониторинге.
Течение АФС, тяжесть и распространенность тромбозов, их рецидивирование непредсказуемы и в большинстве случаев не коррелируют с изменением титров аФЛ-АТ и активностью СКВ. У одних больных АФС проявляется венозными тромбозами, у других – инсультом, у третьих – акушерской патологией или тромбоцитопенией.
Риск развития тромбоза у больных с АФС очень значителен и достигает 70% после эпизода венозного тромбоза и 90% – после артериального [7]. Он наиболее высок:
а) у лиц молодого возраста с постоянно высоким уровнем аКЛ (β2-ГП-1-зависимой популяции АТ), ВА или АТ к β2-ГП-1;
б) при одномоментном обнаружении аКЛ и ВА;
в) при наличии рецидивирующих тромбозов и/или акушерской патологии в анамнезе;
г) при наличии других факторов риска тромботических нарушений (АГ, гиперлипидемии, курение, прием оральных контрацептивов), при обострении основного заболевания (СКВ), наличии сопутствующих мутаций факторов свертывания крови;
д) при быстрой отмене непрямых антикоагулянтов;
е) при сочетании высоких титров аФЛ-АТ с другими нарушениями свертывания, прежде всего мутацией V фактора свертывания крови, а возможно, и дефицитом других белков (антитромбина-ІІІ, протеинов С и S), гомоцистеинемией.
Диагностические критерии АФС
Диагностика АФС основана на определенных сочетаниях клинических признаков и титров аФЛ-АТ. На рабочей конференции по аФЛ-АТ, проведенной в г. Саппоро (Япония) в 1998 г., сформулированы и предложены к апробации новые диагностические критерии [7].
Предварительные классификационные критерии АФС (г. Саппоро, 1998)
Клинические критерии:
Сосудистый тромбоз
Один или более клинических эпизодов артериального, венозного тромбоза или тромбоз мелких сосудов в любой ткани или органе; тромбоз должен быть подтвержден визуализацией изображения, допплеровским исследованием или морфологически, за исключением поверхностных венозных тромбозов; морфологическое подтверждение должно быть представлено тромбозом без наличия значительного воспаления сосудистой стенки.
Патология беременности
а) один или более случаев внутриутробной гибели морфологически нормального плода после 10 нед гестации (нормальные морфологические признаки плода документированы при ультразвуковом исследовании (УЗИ) или непосредственном осмотре плода);
б) один или более случаев преждевременных родов морфологически нормального плода до 34 нед гестации из-за выраженной преэклампсии/эклампсии или плацентарной недостаточности;
в) три или более последовательных случая спонтанных абортов до 10 нед гестации (исключения – анатомические дефекты матки, гормональные нарушения, материнские или отцовские хромосомные нарушения).
Лабораторные критерии:
- аКЛ IgG- или IgM-изотип в крови, представленные в средних или высоких уровнях, выявленные при 2 или более исследованиях с интервалом не менее 6 нед, определяемые стандартным иммуноферментным методом для β2ГП-1-зависимых аКЛ;
- ВА в плазме, выявленные при 2 или более исследованиях с интервалом не менее 6 нед, определяемые согласно руководству Международного общества тромбозов и гемостаза (исследовательская группа по ВА/фосфолипидзависимым антителам):
- удлинение времени свертывания плазмы в фосфолипидзависимых коагулологических тестах: АПТВ, каолиновое, протромбиновое, текстариновое время свертывания, тесты с ядами Рассела;
- отсутствие коррекции удлинения времени свертывания скрининговых исследований в тестах смешивания с донорской плазмой;
- укорочение или коррекция удлинения времени свертывания скрининговых тестов при добавлении фосфолипидов;
- исключение других коагулопатий, например ингибитора VIII фактора или гепарина.
Примечание. Определенный АФС диагностируется при наличии одного клинического и одного лабораторного критериев.
Дифференциальная диагностика
Дифференциальная диагностика АФС проводится с широким спектром заболеваний, протекающих с сосудистыми нарушениями, в первую очередь с системными васкулитами. Необходимо подчеркнуть, что при АФС наблюдается очень большое количество клинических проявлений (псевдосиндромов), которые могут имитировать васкулиты, инфекционный эндокардит, опухоли сердца, рассеянный склероз, гепатит, нефрит и др. В то же время АФС может сочетаться с различными заболеваниями, например c системными васкулитами. АФС должен быть заподозрен в случаях развития тромботических нарушений (особенно множественных, рецидивирующих, с необычной локализацией), тромбоцитопении и акушерской патологии у пациентов молодого и среднего возраста, а также при необъяснимом тромбозе у новорожденных, при некрозе кожи на фоне лечения непрямыми антикоагулянтами и у больных с удлиненным АПТВ при скрининговом исследовании.
У детей и подростков АФС наиболее ярко и часто проявляется при СКВ.
АФС при СКВ в детском возрасте
Частота АФС при СКВ у детей составляет 35%, что совпадает с его распространенностью у взрослых с этой патологией [7]. Частота развития тромбозов у больных СКВ зависит от типа обнаруживаемых у них аФЛ-АТ: при наличии ВА она равна 61%, в случае обнаружения аКЛ – 52%, при их отсутствии – 24%.
Анализ течения АФС у детей с СКВ [7] показал, что симптомы синдрома Hughes могут появиться в любом периоде заболевания, причем у 20% лиц его признаки наблюдаются уже в дебюте CКВ.
Спектр клинических и лабораторных признаков АФС при СКВ у детей представлен в таблице 2. У детей с СКВ и АФС по частоте преобладает тромбоз мелких сосудов кожи. Кожные симптомы могут быть первым его проявлением у пациентов, у которых в дальнейшем развивается мультисистемный тромбоз.
Характерный признак АФС у детей – сетчатое ливедо, часто в сочетании с церебральной патологией (синдром Снеддона). Вместе с тем ливедо отмечается и при других аутоиммунных процессах (узелковом полиартериите, криоглобулинемии), инфекциях, а также в мягкой форме у девочек-подростков, что требует дифференциации [7].
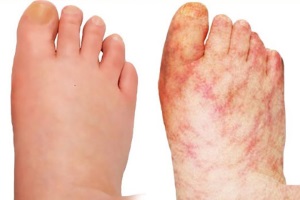
Яркое проявление АФС у детей – дистальная ишемия кожи, проявляющаяся стойкими эритематозными или лиловыми пятнами на пальцах рук и ног и в некоторых случаях сопровождающаяся дигитальным некрозом. У детей реже, чем у взрослых, наблюдаются такие проявления АФС, как тромбоз вен конечностей и хронические язвы голеней и стоп.
Среди неврологических нарушений наиболее часто при СКВ у детей отмечаются признаки ишемической энцефалопатии, нарушение когнитивных функций, психические расстройства, мигренеподобные цефалгии, реже – эписиндром, хореические гиперкинезы, транзиторные нарушения мозгового кровообращения (табл. 2).
У детей с СКВ и аФЛ-АТ отмечается повышенная частота вегетаций на клапанах и митральной регургитации, которые могут быть источником эмболизации. Часто выявляются признаки нарушения коронарного кровообращения и легочной гипертензии. Развитие последней при наличии аФЛ-АТ может быть связано с тромбозом сосудов легких in situ.
Лечение
Лечение АФС остается нерешенной проблемой и представляет сложную задачу в связи с неоднородностью патогенетических механизмов, полиморфизмом клинических проявлений, отсутствием достоверных клинических и лабораторных прогностических критериев рецидивирования тромбоза. Лечение основывается на эмпирических принципах и направлено на устранение гиперкоагуляции и подавление иммунных механизмов АФС [1, 6]. Терапия должна проводиться комплексно и включать лечение острых тромбозов и профилактику их рецидивирования. Лечение проводится только под контролем врача!
Лечение острых тромбозов. Центральное место в лечении острых тромботических осложнений при АФС занимают прямые антикоагулянты – гепарин, в частности препараты низкомолекулярного гепарина (фраксипарин). Дополнительно назначают непрямой антикоагулянт, антагонист витамина К – варфарин. При этом лечение начинают с назначения гепарина, чем достигается быстрый антикоагулянтный эффект, а по достижении удлинения протромбинового времени гепарин можно заменить варфарином для поддержания гипокоагуляции на уровне международного нормализованного отношения (МНО) в пределах 2-3 [6].
При КАФС с полиорганным тромбозом необходимо неотложное интенсивное лечение с использованием всего арсенала методов интенсивной и противовоспалительной терапии, применяемого в критических состояниях при лечении основного заболевания.
Эффективность терапии зависит от возможности устранения факторов, провоцирующих развитие данного АФС, и включает:
- Подавление инфекции назначением адекватной антибактериальной терапии.
- Проведение интенсивной терапии глюкокортикостероидами (ГКС) для купирования синдрома системного воспалительного процесса.
- В тяжелых случаях – пульс-терапия метилпреднизолоном в дозе 1 г в течение 3 дней (у взрослых до 5) с последующим назначением ГКС внутрь в дозе 1,5-2 мг/кг/сут.
- В особо тяжелых случаях – сочетанная пульс-терапия метилпреднизолоном и циклофосфамидом в дозе 0,5-1 г/сут.
- Внутривенный иммуноглобулин (ВВИГ) в течение 4-5 дней в дозе 0,4 г/кг эффективен при наличии тромбоцитопении.
- При очень высоком титре антител может возникнуть вопрос о проведении плазмафереза.
Перспективно для лечения КАФС использование тромболитических препаратов – активированного плазмина (фибринолизина) или активаторов плазминогена (урокиназы, антистреплазы, альтеплазы), однако назначение данных средств сопряжено с высоким риском развития кровотечений, что ограничивает возможности их широкого применения.
Профилактика рецидивирования тромбозов. У больных с высоким уровнем аФЛ-АТ, но без клинических признаков АФС можно ограничиться назначением небольших доз (1-2 мг/кг/сут – 50-100 мг/сут, в среднем 75 мг/сут) ацетилсалициловой кислоты (АСК) (табл. 3). Эти пациенты требуют тщательного амбулаторного мониторинга, так как риск тромбозов у них весьма высок. Наиболее эффективен для профилактики тромбоза любой локализации сочетанный прием варфарина (МНО=1,5) и АСК в низких дозах [6]. Вместе с тем при лечении антикоагулянтами высок риск развития осложнений, в связи с чем необходимы регулярный лабораторный контроль и динамическое наблюдение за больным. Противопоказаниями к их приему являются беременность (могут вызывать нарушение развития нервной системы у плода) и язвенные заболевания ЖКТ; данные средства следует с осторожностью применять при поражении печени или почек.
Лечение первичного АФС ГКС и циклофосфамидом, как правило, неэффективно, за исключением случаев КАФС. Более того, есть данные о том, что длительная ГКС-терапия может увеличивать риск рецидивирования тромбозов. Умеренная тромбоцитопения чаще всего не требует лечения или корригируется небольшими дозами ГКС. Иногда при резистентных к ГКС формах тромбоцитопении эффективны низкие дозы АСК, дапсон, даназол, гидроксихлорохин, варфарин. У больных с тромбоцитопенией в пределах 50-100х106/л можно использовать небольшие дозы варфарина, а более существенное снижение уровня тромбоцитов диктует необходимость назначения ГКС или ВВИГ.
У пациентов с СКВ и АФС развитие тромбозов может быть сопряжено с поражением эндотелия сосудов в связи с текущим васкулитом на фоне обострения основного заболевания, поэтому контроль его активности и предупреждение рецидивов путем проведения базисной терапии крайне важны. Снижение активности СКВ сопровождается снижением уровня аФЛ-АТ, что уменьшает вероятность развития тромбоза.
Интенсивность рекомендуемой терапии при наличии в крови больного СКВ аФЛ-АТ существенно варьирует в зависимости от тяжести состояния, а также данных анамнеза и др. При отсутствии клинических признаков АФС и дополнительных факторов риска развития тромбоза у больного, не имеющего отягощенного по тромбозам или потере плода семейного анамнеза, по мнению ряда авторов [6, 7], никакого профилактического лечения не требуется. Однако положение это спорно, поскольку доказано, что риск развития тромбоза при наличии у больных аФЛ-АТ высок. Таким пациентам при проведении оперативных вмешательств следует назначать гепарин для профилактики тромбоза. В случае АФС без клинических симптомов, но при наличии отягощенного семейного анамнеза и/или дополнительных факторов риска тромбоза рекомендуют проводить профилактическое лечение АСК в низких дозах. Вместе с тем такая профилактика недостаточна у пациентов с высоким уровнем аКЛ. Для повышения ее эффективности возможно подключение к терапии аминохинолиновых препаратов, способных оказывать антитромботическое (подавлять адгезию и агрегацию тромбоцитов, уменьшать размеры тромба) и гиполипидемическое действие, а также контролировать активность СКВ (табл. 3).
Большие надежды возлагают на внедрение новых методов антикоагулянтной терапии, основанных на использовании аргиналов, гируидинов, антикоагулянтных пептидов, антитромбоцитарных агентов (моноклональных антител к тромбоцитам, RGD-пептидов).
Таким образом, для профилактики ретромбоза у больных, особенно с вторичным АФС, следует проводить интенсивное и длительное, в некоторых случаях пожизненное, лечение оральными антикоагулянтами. У пациентов с повторными тромбозами, резистентных к проводимой антикоагулянтной терапии, необходимо исключить наличие сопутствующих нарушений свертывания крови (мутаций гена V фактора, гена протромбина и др.).
Прогноз АФС во многом зависит от своевременности начатого лечения и дисциплинированности пациента. При наличии АФС прогноз у больных СКВ менее благоприятен. Показатели выживаемости пациентов с СКВ и АФС ниже, чем у больных СКВ без АФС. Летальность связана с развитием таких клинических проявлений, как инсульт, поперечный миелит, инфаркт миокарда, эндокардит, тромбоэмболия сосудов легких, легочная гипертензия, нефропатия, гангрена конечностей и др., причем частота их выше у более молодых пациентов. Прогноз при развитии КАФС неблагоприятный. Летальный исход наблюдается практически у каждого второго пациента (48%) [7]. Наиболее частые причины смерти – сердечная недостаточность на фоне тромбоза мелких сосудов миокарда, острый инфаркт миокарда, легочная недостаточность на фоне острого респираторного дистресс-синдрома или диффузных альвеолярных геморрагий.
В качестве иллюстрации к вышеизложенному приводим данные нашего наблюдения.
Клинический случай
Девочка М., 1987 г. рождения, наблюдается в педиатрическом отделении УДСБ «Охматдет» (г. Киев) по поводу СКВ с 2002 г.
По данным анамнеза известно, что девочка родилась от возрастных здоровых родителей, от 2-й беременности с угрозой прерывания в сроке 5 мес и 2 срочных родов, протекавших с гипоксией плода. До 9 лет росла и развивалась без особенностей, привита по календарю. Семейный, индивидуальный аллергологический и инфекционный анамнезы не отягощены.
В 1996 г. (в возрасте 9 лет) в Одесской детской больнице впервые поставлен диагноз СКВ, назначено лечение преднизолоном внутрь в дозе 40 мг/кг/сут.
В возрасте 12 лет (1999 г.) на фоне рецидива болезни (дерматит в виде бабочки) впервые появились трофические расстройства, похолодание, парестезии, акроцианоз и отечность кистей и стоп, мелкие некрозы кончиков пальцев, преимущественно верхних конечностей, в связи с чем обследована в Клинике детских болезней Московской медицинской академии имени И.М. Сеченова (Всероссийский детский центр по лечению диффузных заболеваний соединительной ткани). Проведено комплексное обследование:
- реовазография предплечий и голеней: пульсовое наполнение справа на предплечье умеренно снижено, слева значительно снижено (D>S=60%), в области кистей, голеней и стоп – значительно снижено (D≈S), гипотонус артерий, венозный отток не нарушен);
- Эхокардиограмма: Dd=41 мм, D=28 мм, EF=58%, FS=30%, Jo=41,5%, Jvd=7 мм, Lnd=8 мм, LA=23 мм, перикард 5 мм, «слоистый»; гемодинамика сохранена; выпота нет; гемодинамически регургитации на клапанах не выявлено; диаметры полостей не изменены;
- иммунологическое обследование: АНФ – «++» в титре 1:160 (все виды свечения), IgG>2000 мг% (в норме до 1400), антикардиолипиновые АТ-IgM – 42,1 мг% (в норме 0-26), антикардиолипиновые АТ-IgG – 29,9 мг% (в норме до 23); обнаружены антицитонейтрофильные АТ (ANCA) к элементам сосудистой стенки, т.е. иммунологически заболевание имело высокую степень активности (II-III ст.).
Поставлен диагноз: СКВ, подострое течение, дерматит, антифосфолипидная васкулопатия (нарушение микроциркуляции и развитие микротромбов), синдром Рейно (дисциркуляция в микрососудах кистей и стоп), трофические нарушения, поражение ЦНС (цефалгии), остаточные проявления миоперикардита. Назначено лечение: преднизолон в дозе 30-40 мг/сут внутрь с ежедневным приемом, внутривенное введение циклофосфана 1 раз в 2 нед в дозе 250-400 мг (10-12 мг/кг) ежемесячно в течение 4-6 мес до получения стойкого эффекта (при отсутствии осложнений и побочных эффектов), далее по 250 мг – 1 раз в месяц до общей дозы 6 г. Дозу преднизолона уменьшали по 5 мг через 3 нед в 1 месяц, далее – по 2,5 мг через 2-3 нед. Поддерживающую дозу преднизолона определяли по клиническому состоянию (проявлениям дерматита) и иммунологическим данным.
После успешного лечения в клинике в последующем рекомендации по дальнейшему ведению ребенка в полном объеме не были выполнены.
Первая госпитализация в УДСБ «Охматдет» (2002 г., 15 лет) обусловлена обострением СКВ («бабочка», артралгии, геморрагическая сыпь на стопах, акроцианоз, резкая боль и отечность в области кистей и стоп, быстро прогрессирующие язвенно-некротические поражения конечностей, преимущественно верхних). По данным обследования: скорость оседания эритроцитов (СОЭ) – 18-24 мм/ч, уровень сывороточного железа – 10,4 ммоль/л, LE-клетки и АТ к дезоксирибонуклеопротеину (DNP) – не обнаружены, RW – отрицательна. Получала лечение: вазоактивные препараты, курс гипербарической оксигенации (ГБО), дезагреганты, пероральную ГКС-терапию. Выписана со значительным улучшением через 1,5 мес в состоянии клинико-лабораторной ремиссии с рекомендациями по систематическому ежедневному проведению поддерживающей терапии метипредом в дозе не ниже 8 мг/сут.
 Профилактика и лечение антифосфолипидного синдрома: современные рекомендации и перспективы
Профилактика и лечение антифосфолипидного синдрома: современные рекомендации и перспективы
 Антифосфолипидный синдром и невынашивание беременности
Антифосфолипидный синдром и невынашивание беременности
 Профилактика и лечение антифосфолипидного синдрома: современные рекомендации и перспективы
Профилактика и лечение антифосфолипидного синдрома: современные рекомендации и перспективы
 Генетические и приобретенные формы тромбофилии и метаболический синдром
Генетические и приобретенные формы тромбофилии и метаболический синдром
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення


