- Головна
- /
- Статті
- /
- Школа здоров'я
- /
- Генерики — мифы и реалии
Генерики — мифы и реалии

В последнее время появилось множество публикаций, посвященных сравнению и сопоставлению оригинальных препаратов (брэндов) и их воспроизведенных копий (генериков). Так, журнал «Ремедиум» (июль-август, 2003 г.) приводит следующие
В последнее время появилось множество публикаций, посвященных сравнению и сопоставлению оригинальных препаратов (брэндов) и их воспроизведенных копий (генериков). Так, журнал «Ремедиум» (июль-август, 2003 г.) приводит следующие данные — объем продаж воспроизведенных лекарственных препаратов составляет: в США — около 25%, Германии — 35%, Великобритании — 55%, Венгрии — 55%, Польше — 61%, Словакии — 66%.
В России из 13 тыс. зарегистрированных препаратов более 78% — генерики. В западных странах компании-производители выводят оригинальный препарат на фармрынок и используют свое монопольное право на протяжении всего срока действия патента, лишь по истечении этого срока появляются генерики. Раньше во многих странах Восточной Европы наблюдался нетрадиционный для лекарственных препаратов путь к потребителю — зачастую сначала появлялся генерик, а затем — оригинальный препарат.
Вопрос идентичности действия на организм генериков и оригинальных препаратов — главный и для врачей, и для пациентов. В клинической практике врачи обращают внимание на то, что одно и то же химическое вещество, произведенное в виде лекарства различными фармацевтическими компаниями, проявляет себя по-разному. Врачи из личных наблюдений формируют мнение об эффективности существующих на фармацевтическом рынке препаратов, частоте побочных действий при их приеме. Некоторые больные особенно чувствительны к копиям. Так как очень немногие из производителей генериков отслеживают нежелательные эффекты своих препаратов, ответственность за побочные реакции автоматически возлагается и на оригинальный препарат.
При наличии огромного числа генерических препаратов регулирующие органы России способны лишь в процессе регистрации лекарственного препарата оценить качество продукта, текущего контроля за качеством генерических препаратов практически нет. Полноценный контроль означает не только оценку фармацевтических свойств, но и фармакокинетический контроль, в том числе на животных. Чтобы понять глубину обсуждаемых проблем, необходимо обратиться к некоторым разделам классификации лекарственных веществ. Формально использование термина «генерик», когда речь идет о любом непатентованном воспроизведенном препарате, является ошибкой. Однако в России эта ошибка возведена в ранг нормы. Воспроизведенный лекарственный препарат (генерик) — это лекарственный продукт, обладающий доказанной терапевтической взаимозаменяемостью с оригинальным инновационным лекарственным средством аналогичного состава, выпускаемый производителем, но не разработчиком оригинального препарата и без лицензии разработчика. Обычно генерик допускается в обращение после истечения срока патентной защиты оригинального препарата, как правило, на основании оценки регистрационного досье сокращенного объема и данных биоэквивалентности. Оригинальный препарат — это впервые синтезированное и прошедшее полный цикл доклинических и клинических исследований лекарственное средство, активные ингредиенты которого защищены патентом на определенный срок. В большинстве развитых стран приоритет разработчика охраняется законодательно патентной защитой оригинального препарата. Для компенсации своих больших расходов фирмы-разработчики поддерживают более высокие цены на лекарственные препараты. Есть патентный закон и в Российской Федерации, и, согласно мнению экспертов, этот закон максимально соответствует мировым стандартам в области правовой охраны промышленной собственности. Опираясь на новое российское патентное право, производитель может получить патент как на продукт (химическое вещество), так и на способ его производства. Следует заметить, что в РФ монопольное право держателя патента ограничено определенным сроком действия, а именно — 20 лет, и пространством — территорией страны. По истечении срока патента любая фармацевтическая компания может приобрести право на производство собственной версии оригинального препарата, то есть создать генерик. Формальные требования для производства генериковых и оригинальных лекарственных препаратов должны быть сходными и соответствовать принципам и правилам надлежащей производственной практики — GMP (Good Manufacture Practice) — это требования ВОЗ к производству лекарственных препаратов, регламентирующие жесткие стандарты по производственным помещениям, оборудованию, сырью, персоналу, методам контроля и многому другому, что, в конечном итоге, гарантирует качество продукции. Понятие эквивалентности, иными словами равнозначности лекарств, является одним из важнейших, но далеко не единственным критерием при сравнении генериков с оригинальными препаратами. По современным представлениям, следует выделить 3 типа эквивалентности оригинального и генерического лекарственного средства:
- фармакокинетическая эквивалентность (биоэквивалентность), изученная на добровольцах, реже, при особых условиях, на больных (ВИЧ-инфекция, онкологические заболевания, психозы, депрессии и т.д.) или на животных (по этическим соображениям);
- клиническая терапевтическая эквивалентность лекарств, по эффективности изученная на больных людях;
- клиническая терапевтическая эффективность лекарств с акцентом на переносимость и безопасность при применении у пациентов с определенным патологическим состоянием.
Кроме того, учитывается фармакоэкономическая приемлемость генерического препарата по сравнению с оригинальным. Фармакокинетическая эквивалентность на практике — это определение скорости и степени всасывания оригинального (инновационного) лекарства и генерика при приеме в одинаковых дозах и лекарственных формах внутрь или другими способами на основании определения концентрации в жидкостях и тканях организма (биодоступность). Два лекарственных препарата являются биоэквивалентными, если они обеспечивают одинаковую биодоступность лекарственного средства. Относительная биодоступность — это относительное количество лекарственного средства, которое достигает системного кровотока (степень всасывания), и скорость, с которой этот процесс происходит (скорость всасывания). После введения двух лекарственных веществ в одинаковой молярной дозе биодоступность их сходна в такой степени, что эффективность и безопасность данных препаратов, в основном, одинаковы. Исследования биоэквивалентности (фармакокинетической эквивалентности) — это не альтернатива испытанию фармацевтической эквивалентности — эквивалентности воспроизведенных препаратов по качественному и количественному составу лекарственных средств, оцениваемому по фармакопейным тестам, поскольку фармацевтическая эквивалентность не гарантирует эквивалентности фармакокинетической. При исследовании биоэквивалентности генериков в качестве препарата сравнения следует использовать соответствующий оригинальный препарат (или наиболее эффективный аналог этого препарата), официально зарегистрированный в РФ. Содержание лекарственного средства в исследуемом препарате и препарате сравнения не должно отличаться более чем на 5%. В то же время исследование биоэквивалентности лишь предполагает, что фармакокинетически эквивалентные оригиналу воспроизведенные препараты обеспечивают одинаковую эффективность и безопасность фармакотерапии. Однако один из самых важных показателей — биоэквивалентность генериков — может значительно отличаться от оригинала: согласно российским требованиям и регламенту FDA отдельные показатели фармакокинетики могут отличаться до 20%. В связи с этим совершенно очевидно, что реальная ситуация требует ужесточения и расширения требований к фармакокинетическим исследованиям: обязательно изучение на российской популяции, определение параметров при длительном применении, исследование связи «доза — концентрация — эффект». На повестке дня стоит вопрос об уменьшении различий в параметрах с 15-20% до 10-15%, что позволит уменьшить число препаратов с пограничными фармакокинетическими параметрами. Необходимо определить перечень наиболее социально востребованных генериков, потребность по международным непатентованным наименованиям одного препарата, составить российский перечень препаратов сравнения. В США такой перечень препаратов сравнения ежегодно пересматривается FDA. Для социально значимых лекарств необходимо разработать регламент требований качества, включая тест на растворение и сравнительные фармакокинетические исследования на животных. Подобные исследования необходимо проводить выборочно через 3 года после появления препарата на рынке. Важнейшим показателем в комплексной оценке фармакокинетической биоэквивалентности является расчет стоимости исследования. В подавляющем большинстве случаев этот расчет представляется согласованной договорной ценой между заказчиком и исполнителем. Существуют строгие фармакоэкономические критерии стоимости исследований биоэквивалентности. Они состоят из прямых медицинских затрат, включающих стоимость лекарств, медицинского наблюдения, медицинских диагностических процедур и обследований, разработки аналитического метода, проведения клинико-аналитических анализов, оплаты труда химиков-аналитиков, амортизации химико-аналитических приборов, пребывания добровольца в клинике, математического моделирования статистики, а также немедицинских затрат — расходов волонтеров во время пребывания в клинике, транспортные издержки, особое питание и создание в блоке домашних условий (телевизор, игры, библиотека).
К косвенным непрямым затратам можно отнести оплату больничного листа, страхование добровольцев и медперсонала, возможность неблагоприятных клинических исходов.
Учитывая то, что создание и изучение свойств генериков существенно менее затратно по сравнению с оригинальным препаратом, генерик всегда дешевле. Для производства генериков необходимы активные лекарственные субстанции. Поскольку стоимость субстанции приблизительно составляет половину себестоимости производства генериков, в целях снижения затрат ведутся поиски недорогих субстанций. И часто их качество оказывается невысоким, причиной может быть изменение методов синтеза (токсичные примеси, продукты деградации и т.д.). К сожалению, фармакопейные статьи не отражают тонкостей в измении синтеза, для этого необходима экономико-аналитическая экспертиза субстанции. Одним из негативных факторов является то, что субстанции для генериков часто производятся в странах, мало доступных для контроля (Китай, Индия, Вьетнам, Украина), и часто связь поставщиков с клиентами осуществляется через множество посредников или перекупщиков, которые могут иметь дело не с одним, а с несколькими производителями одной и той же субстанции. Производство и контроль качества генериков зависят также от вспомогательных веществ (наполнителей). Требования к ним должны быть такие же, как и к активной субстанции. Основные требования касаются изучения реологических свойств, растворимости и кинетики pacтвopeния: гранулометрической кривой, проведения тестов на стабильность и другие. Любое изменение в составе вспомогательных веществ или оболочки лекарства могут существенно изменить качество препарата, его биодоступность, привести к токсическим или аллергическим явлениям. В производстве и контроле качества генериков важное место занимают и упаковочные материалы (контейнеры), так как они непосредственно контактируют с лекарственным средством. При этом требования, предъявляемые к упаковочным материалам, зависят от климатических условий.
И наконец, главный вопрос, на который следует ответить, — это вопрос о терапевтической эквивалентности. Для доказательства ее требуется проведение клинических исследований лекарства-генерика на больных, сравнительных клинических исследований оригинального препарата и генерика на больных, а также изучение профиля безопасности последнего.
В Европейском Союзе и в США отрицательно относятся к фармакокинетической эквивалентности как к единственному способу оценки равнозначности лекарства. Все чаще звучат требования о проведении клинических исследований наиболее важных для общества воспроизведенных лекарственных средств. Клиническая терапевтическая эквивалентность подразумевает проведение как ограниченных, так и крупных клинических исследований эффективности генерика при конкретном заболевании и изучение сравнительной эффективности оригинального и воспроизведенного препарата с использованием четких конечных критериев — достижение целевого уровня АД или холестерина, увеличение ОФВ1 (объема форсированного выдоха за первую секунду), скорость рубцевания язв и т.д. Клиническая терапевтическая эквивалентность означает и организацию исследований по безопасности генериков — по крайней мере, в течение 5 лет после регистрации необходим интенсивный мониторинг нежелательных эффектов. Клинические исследования генериков, проводимые по типу открытых несравнительных и сравнительных исследований, должны осуществляться по строгому протоколу с полным соблюдением дизайна исследования, при этом расплывчатое заключение «препарат эффективен» не должно употребляться. Оценка эффективности генерика должна основываться не только на субъективных ощущениях больного и врача, а, в первую очередь, на достижении целевых клинических точек, объективно отражающих эффект препарата: целевой уровень АД и холестерина, исчезновение аритмий, прирост показателя форсированного выдоха, сроки нормализации температуры и эрадикации возбудителя инфекции, оценка состояния больного по специальным опросникам и т.д. Следует учитывать не только число больных, достигших в результате лечения целевых уровней здоровья, но и дозу препарата, которая потребовалась. Примером клинической неэквивалентности препаратов эналаприла служат данные, полученные в рандомизированном исследовании, проведенном В.И. Петровым и С.В. Недогодой. Исследована клиническая эффективность по достижению целевого уровня АД у больных артериальной гипертонией пяти препаратов эналаприла (Ренитек, Энап, Эднит, Инворил и Энам). Указанные генерики были фармакокинетически эквивалентны оригинальному препарату Ренитек фирмы MSD. Для достижения целевого уровня АД средняя доза Ренитека для одного больного составила 12 мг/сут, Энапа — 15 мг/сут, Эднита — 15,6 мг/сут, Инворила — 20,6 мг/сут, Энама — 36,6 мг/сут. На основании полученных результатов был сделан вывод о неодинаковой терапевтической эффективности воспроизведенных препаратов эналаприла и развеян миф о дешевизне генериков, так как затраты при их применении были гораздо выше, чем при использовании оригинального Ренитека. Особое значение эквивалентность генериков имеет для антимикробных препаратов, так как низкая антимикробная активность может приводить к снижению клинической эффективности лечения, что особенно важно при лечении тяжелых больных, и быстрому распространению резистентных форм микробов. Недавно проведенное исследование микологической активности оригинального флуконазола (Дифлюкан, Pfizer) и генерических препаратов (Медофлюкон, Микосист, Флюкостат, Форкам) показало, что активность генериков против различных видов грибов рода Candida в 2 раза меньше, чем у Дифлюкана. В одной из научных публикаций профессор Nightingale (США) приводит данные сравнительного анализа качества оригинального, кларитромицина производства компании Abbott и 40 его генериков из 13 стран Азии и Латинской Америки. Результаты оказались малоутешительными: в 8 препаратах содержание активного вещества не соответствовало стандартам компании-разработчика, у 28 генериков количество высвобождающегося при растворении активного компонента было значительно ниже, чем у оригинального, хотя все они имели соответствующую спецификацию. У 24 из 40 был превышен рекомендованный компанией Abbott 3-процентный лимит посторонних примесей; в 10 раз увеличено количество твердых частиц в воспроизведенных препаратах цефотаксима (Цефантрем, Lupin, Токсим, Alkem) по сравнению с оригинальным Клафораном.
Данные частицы, содержащиеся в генериках, значительно нарушают микроциркуляцию в ишемизированных тканях и могут способствовать у тяжелых больных развитию респираторного дистресс-синдрома и полиорганной недостаточности. Большое беспокойство у специалистов вызывает назначение генериков больным с эпилепсией. В настоящее время эффективность противоэпилептической терапии определяется не только снижением частоты припадков и степени тяжести заболевания, но и улучшением качества жизни больных эпилепсией, при наблюдающейся общемировой тенденции увеличения средней продолжительности жизни. В лечении хронических заболеваний часто невозможно достичь полного выздоровления, следовательно, необходимо стремиться ограничить прогрессирование заболевания, то есть повлиять на качество жизни. По мнению исследователей, основными критериями эффективности противоэпилептической терапии являются: максимальный контроль над припадками, минимальное количество побочных эффектов, оптимальное качество жизни. В связи с тем, что больные эпилепсией вынуждены принимать противоэпилептические препараты в течение длительного времени, это нередко приводит к побочным эффектам, снижающим качество жизни пациентов, их социальную и семейную адаптацию, что сводит к минимуму терапевтическую ценность противоэпилептической терапии. Таким образом, качество жизни является показателем эффективности лечения.
В проспективном исследовании по изучению клинической эффективности отдельных схем лечения эпилепсии — комплексной поли- и монотерапии — с анализом качества жизни пациентов и фармакоэкономическим анализом, проведенных в 2000-2001 гг., было проиллюстрировано мнение специалистов о необходимости применения оригинальных противоэпилептических препаратов, так как такое предпочтение брэндов совпадает с интересом к биодоступности генериковых лекарственных форм. При оценке качества жизни больных эпилепсией положительный результат превалирует у вальпроатов, причем наибольший — у препарата Депакин-Хроно. При расчете фармакоэкономических показателей в группе вальпроатов соотношение стоимость/эффективность (СЕА) и стоимость/полезность (CUA) были наилучшими у Депакина, особенно у Депакина-Хроно. Данное исследование показало, что в группе больных, получающих карбамазепины, несмотря на низкую стоимость Карбамазепина-Акри (Акрихин), тяжесть состояния больных не уменьшалась, больных чаще госпитализировали, что приводило к дополнительным расходам, превосходящим стоимость оригинальных препаратов (Тегретол). Результаты этого исследования свидетельствуют о том, что переход с недорогих генериков на оригинальные препараты выгоден как для пациентов, так и для общества в целом. На примере фармакоэкономического анализа терапии эпилепсии и оценки качества жизни больных с эпилепсией можно продемонстрировать вариабельность показателей стоимости терапии и то, как это соотносится с безопасностью и эффективностью лечения. В другом исследовании на базе 40 американских амбулаторных центров было выявлено 2285 пациентов, страдающих эпилепсией, которые в качестве противоэпилептической терапии получали вальпроат натрия, карбамазепин, фенитоин. Были подготовлены опросники и сопроводительные письма для пациентов, которые были направлены им врачами общей практики, участвующими в исследовании. Письма были разосланы пациентам, получавшим карбамазепин, фенитоин или вальпроат натрия в качестве противоэпилептического препарата (информация об этих пациентах была получена из медицинских документов). Выбор именно этих трех препаратов основывался на том, что они часто назначаются и имеют различные аналоги (генерики). Пациенты, заполнившие опросники, принимали различные аналоги одного и того же противоэпилептического препарата в течение последних двух лет, они были взяты под наблюдение в своих амбулаторных центрах, если сообщили об имеющихся у них проблемах, связанных с изменением частоты эпилептических приступов и характера побочных эффектов после смены препарата. Те пациенты, которые в течение двух последних лет принимали различные аналоги одного противоэпилептического препарата, прошли собеседование, в ходе которого выяснялось, наблюдалось ли у них изменение частоты эпилептических приступов или характера побочных эффектов при переходе на прием другого аналога препарата. На вопросы ответили 1333 (58,8%) пациента, страдающие эпилепсией. Средний возраст пациентов составил 45 лет, средний возраст дебюта эпилепсии — 30 лет, средняя частота приступов — 7,3 в месяц. У 10,8% пациентов были выявлены проблемы, однозначно связанные с изменением терапии; у 9,9% — проблемы, которые могли быть связаны с изменением терапии; 22 пациента сообщили об имеющихся проблемах, однако катамнестические сведения были собраны не полностью; только 70,5% пациентов сообщили о том, что у них отсутствовали какие-либо проблемы. 39,2% пациентов, участвующих в исследовании, на момент проведения исследования принимали в качестве противоэпилептической терапии вальпроат натрия, 37,8% — карбамазепин и 32,6% — фенитоин (общий процент превышает 100% в связи с тем, что часть пациентов находилась на политерапии), 73,9% пациентов получали монотерапию: 22,1% — 2 препарата, 3,6% — 3 препарата, 0,4% — 4 или более препаратов. В общей выборке у 45,3% больных отсутствовали эпилептические приступы и не отмечалось побочных эффектов, у 12,6% пациентов приступы отсутствовали, но наблюдались побочные эффекты, 26,3% пациентов считали лечение успешным, несмотря на сохранение приступов, и 15,8% пациентов были недовольны результатами лечения, 18,7% пациентов были переведены на другой препарат. О появлении проблем, связанных с заменой препарата на его аналог, сообщили 10,8% пациентов. Проблемы наблюдались при переводе с оригинального препарата на генерик (68%), с генерика — на оригинальный препарат (12%) и с генерика — на генерик (20%). После замены оригинального препарата на его копию (генерик) у 70,5% не отмечалось никаких проблем, 29,5% больных сообщили об имеющихся у них проблемах.
Кроме различия в биодоступности препаратов, к появлению данных проблем могли привести и другие причины: например, стресс, беспокойство, дискомфорт, связанные с изменением размера и цвета таблеток, изменение привычных свойств лекарства и ухудшение методики его производства. В 27 случаях (10,8%) врачи, курирующие пациентов, однозначно считали, что именно переключение явилось основной причиной неблагоприятных эффектов. Проблемы, возникающие вследствие перевода, особенно увеличения частоты приступов или побочных эффектов, могут повысить социальные затраты посредством увеличения количества дней нетрудоспособности, оплаты больничных листов и других страховых пособий по болезни.
Таким образом, данные, полученные в результате сравнительных исследований, позволяют сделать важный вывод: недопустимо переносить данные по эффективности и безопасности, полученные на оригинальных препаратах, на их копии. Лишь наличие полной информации о соблюдении требований GMP при производстве генерика, фармакокинетическая и терапевтическая его эквивалентность при сравнении с оригинальным препаратом делают обоснованным поиск фармакоэкономических преимуществ генерика. В противном случае формально выгодные ценовые показатели могут обернуться огромными дополнительными расходами, например, на лечение нежелательных побочных явлений. Как правило, большинство оригинальных препаратов производятся в соответствии со стандартами GMP и прошли, помимо фармакокинетического исследования в различных условиях, расширенные клинические исследования до IV фазы. По-видимому, все генерики, производимые не по стандартам GMP, должны проходить если не расширенные клинические исследования, то полноценные ограниченные клинические исследования по строгому протоколу. Механический перенос показаний к применению лекарств, описанных для оригинального инновационного средства, следует строго ограничивать, расширение показаний возможно лишь при наличии у генериковой компании собственного опыта применения препарата в России.
Наиболее широкое использование генериков наблюдается при социально значимых заболеваниях, имеющих большую распространенность (артериальная гипертония, сердечная недостаточность, бронхиальная астма, эпилепсия, депрессивное состояние, туберкулез, наркомания, гепатиты, рак толстой кишки и молочной железы, диабет и т.д.). В этой связи изменений течения и исхода социально значимых заболеваний можно добиться, только используя относительно доступные и высококачественные генерики. Поэтому необходимо исследование этой группы лекарств по всему спектру эквивалентности, тем более что большая часть этих лекарств оплачивается из бюджета государства или ФОМС. Такой подход должен подтолкнуть генериковые компании к изменению философии в продвижении препаратов от единственной цели получения прибыли до сочетания получения прибыли и выполнения социальных функций в тех странах, где они работают. В таких условиях монополия фармацевтических гигантов на организацию больших исследований может быть поколеблена. Привлекательность такого подхода для общества несомненна: примером могут служить Великобритания, Германия, США, Швеция, в которых большинство больных лейкозом, раком, СПИДом, рассеянным склерозом, болезнью Альцгеймера и т.д. вовлечены в программы с применением как установившихся, так и новейших методов лечения. Кроме того, важным нерешенным на сегодняшний день вопросом остается доступность информации о взаимозаменяемости оригинального препарата и генерика.
Управление по контролю за качеством продуктов и лекарственных средств США (FDA) не рекомендует в качестве замены использовать лекарственные препараты, которым присвоен код «В». К таким препаратам относятся лекарственные средства, которые по разным причинам на данный момент нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения. Врачи США быстро обнаруживают код рецептурного лекарства или в специальных ежегодных изданиях, или в Интернете, обеспечивая таким образом необходимую безопасность при работе с генериками.
В нашей стране возможно выделение, как это сделано в США, двух групп генериков: для первой имеются данные о фармакокинетической и клинической эквивалентности, а для второй существуют лишь данные по фармакокинетике, а клинические данные по эффективности и безопасности находятся в стадии исследования или не обобщены.
Заключение В РФ пока нет централизованной базы данных для врачей и провизоров по оригинальным и воспроизведенным лекарствам. Доступность объективной информации о терапевтической эквивалентности генериков позволила специалистам уверенно использовать взаимозаменяемые лекарства, принимать во внимание и экономические преимущества, а значит, повысить качество медицинского обслуживания населения. Количество непатентованных препаратов на мировом и отечественном фармацевтических рынках с каждым годом увеличивается. Однако экономические соображения и дефицит средств не должны затмевать проблему безопасности лекарственных средств у фондов социального и медицинского страхования. Оригинальные препараты снова и снова будут противопоставлять генерикам и приводить аргументы «pro et contra», но их конкуренция на фармацевтическом рынке должна базироваться на строгом соблюдении требований к качеству производства как оригинальных, так и воспроизведенных препаратов, на результатах анализов биоэквивалентности, а также на результатах клинических исследований. Практика, сложившаяся в РФ, разрешающая медицинское применения генерика на основании данных только о его биоэквивалентности, порочна. Следует организовать обсервационные ретро- и проспективные исследования генериков в плане выявления резистентности к лечению и развития нежелательных эффектов. Необходимо усилить роль Минздрава России как регуляторного органа в плане регистрации и разрешения медицинского применения воспроизведенных препаратов. При полном обеспечении населения конкретным препаратом вопрос о регистрации очередного генерика должен решаться отрицательно. Следует сократить сроки действия регистрации препарата при его отсутствии на фармацевтическом рынке или вовсе лишать компанию выданного свидетельства. Только комплекс мероприятий может оказать существенное влияние как на количество, так и на качество воспроизведенных препаратов.
 О недостаточности кровообращения и дефиците ... этики
О недостаточности кровообращения и дефиците ... этики
 Проспективное многоцентровое открытое исследование эффективности и переносимости КВАдроприла у больных с Недостаточностью Кровообращения, обусловленной ишемической болезнью сердца и дилатационной кардиомиопатией (Исследование КВАНК)
Проспективное многоцентровое открытое исследование эффективности и переносимости КВАдроприла у больных с Недостаточностью Кровообращения, обусловленной ишемической болезнью сердца и дилатационной кардиомиопатией (Исследование КВАНК)
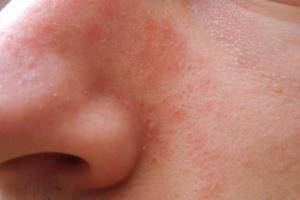 Кандидозные поражения кожи и слизистых оболочек
Кандидозные поражения кожи и слизистых оболочек
 Особенности патогенеза и новые подходы к лечению больных хроническим обструктивным заболеванием легких, осложнившимся недостаточностью кровообращения
Особенности патогенеза и новые подходы к лечению больных хроническим обструктивным заболеванием легких, осложнившимся недостаточностью кровообращения
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення


