Неходжкинские лимфомы: современная терапия повышает шансы победить болезнь
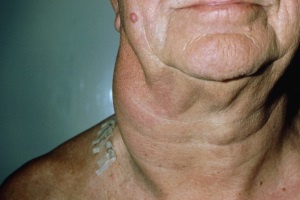
Неходжкинские лимфомы (НЛ) остаются одной из наиболее сложных проблем современной онкологии. Ежегодно уровень заболеваемости повышается на 2-3% и за последние 20 лет увеличился практически вдвое. Для выбора эффективной тактики лечения НЛ необходимо точно определить морфологическую и иммунофенотипическую характеристики опухолевых клеток, что требует применения современных иммунологических и цитогенетических исследований.
Это связано с тем, что опухоль может находиться на различных стадиях клеточной дифференцировки, а также обладать морфологической изменчивостью, свойственной всем опухолям лимфоидной ткани. Ведь каждый этап созревания лимфоидных клеток, который сопровождается возникновением или исчезновением соответствующих антигенов и рецепторов, а также молекулярно-биологическими изменениями, может дать начало патологическому клону лимфоцитов.
Однако даже точная диагностика типа опухоли и правильно подобранная терапия далеко не всегда могут гарантировать достижение стойкой и длительной ремиссии. Тем не менее у врачей и больных есть повод для оптимизма: несколько лет назад появились принципиально новые препараты на основе моноклональных антител, применение которых позволяет улучшить прогноз заболевания и увеличить долю пациентов с полным излечением. Об этом шла речь 22-23 февраля на научно-практической конференции, приуроченной к 20-летию гематологического отделения Научного центра радиационной медицины (НЦРМ) АМН Украины «Радиационная гематология: этапы становления, основные достижения и перспективы развития».
Первый доклад был представлен известным российским ученым, заведующим отделением клинической онкологии Федерального научно-клинического центра детской гематологии, онкологии и иммунологии Росздрава, доктором медицинских наук В.В. Птушкиным, который подробно остановился на современных принципах диагностики и лечения НЛ.
 – Неходжкинские лимфомы – гетерогенная группа опухолей лимфоидного ростка кроветворения, включающая как быстро прогрессирующие, так и относительно доброкачественно текущие или индолентные неоплазии. Эти опухоли значительно различаются по своим клеточным источникам (неопухолевым аналогам), морфологии, цитогенетическим нарушениям, чувствительности к химио/радиотерапии и общему прогнозу. Существуют различные классификации лимфом, но в большинстве из них, помимо деления на В и Т (NK) линии, применяется дополнительное подразделение этих опухолей в зависимости от характера клинического течения на индолентные (медленно развивающиеся), а также агрессивные и даже сверхагрессивные. К индолентным, или лимфомам низкой степени злокачественности, относят лимфоцитарную лимфому из мелких клеток/хронический лимфобластный лейкоз (ХЛЛ), лимфоплазмоцитарную лимфому/макроглобулинемию Вальденстрема, спленическую лимфому маргинальной зоны, экстранодальные В-клеточные опухоли маргинальной зоны/МАLТ-лимфомы, фолликулярную лимфому (ФЛ) I и II цитологического типа. К агрессивным лимфомам, или лимфомам высокой степени злокачественности, относят диффузную крупноклеточную лимфому (ДККЛ), фолликулярную лимфому III цитологического типа, мантийноклеточную лимфому (иногда ее относят и к индолентным лимфомам), множественную миелому. К сверхагрессивным относят лимфомы из клеток предшественников, лимфому Беркитта и плазмоклеточный лейкоз. Это разделение, во многом условное, определяется принципиально различными подходами к их начальному лечению.
– Неходжкинские лимфомы – гетерогенная группа опухолей лимфоидного ростка кроветворения, включающая как быстро прогрессирующие, так и относительно доброкачественно текущие или индолентные неоплазии. Эти опухоли значительно различаются по своим клеточным источникам (неопухолевым аналогам), морфологии, цитогенетическим нарушениям, чувствительности к химио/радиотерапии и общему прогнозу. Существуют различные классификации лимфом, но в большинстве из них, помимо деления на В и Т (NK) линии, применяется дополнительное подразделение этих опухолей в зависимости от характера клинического течения на индолентные (медленно развивающиеся), а также агрессивные и даже сверхагрессивные. К индолентным, или лимфомам низкой степени злокачественности, относят лимфоцитарную лимфому из мелких клеток/хронический лимфобластный лейкоз (ХЛЛ), лимфоплазмоцитарную лимфому/макроглобулинемию Вальденстрема, спленическую лимфому маргинальной зоны, экстранодальные В-клеточные опухоли маргинальной зоны/МАLТ-лимфомы, фолликулярную лимфому (ФЛ) I и II цитологического типа. К агрессивным лимфомам, или лимфомам высокой степени злокачественности, относят диффузную крупноклеточную лимфому (ДККЛ), фолликулярную лимфому III цитологического типа, мантийноклеточную лимфому (иногда ее относят и к индолентным лимфомам), множественную миелому. К сверхагрессивным относят лимфомы из клеток предшественников, лимфому Беркитта и плазмоклеточный лейкоз. Это разделение, во многом условное, определяется принципиально различными подходами к их начальному лечению.
Больные с индолентными лимфомами на первом этапе могут не получать лечения, и такая тактика «наблюдать и ждать», по некоторым данным, не сокращает продолжительности жизни. Она в первую очередь применяется при медленно прогрессирующих фолликулярных лимфомах, ХЛЛ и других. При появлении симптомов поражения внутренних органов или быстром прогрессировании проводится облучение, моно- или полихимиотерапия, применяются моноклональные антитела, в том числе совместно с цитостатиками, или проводится интенсивная химиотерапия с аутологичной или аллогенной трансплантацией стволовых кроветворных клеток.
Лечение агрессивных лимфом даже на самом раннем этапе развития болезни включает полихимиотерапию с или без радиотерапии. Последние годы для начальной терапии В-клеточных лимфом высокой степени злокачественности стали широко применяться моноклональные антитела в комбинации с цитостатиками.
У больных с рецидивами индолентных лимфом или с резистентностью к начальному лечению сохраняется практически столь же широкий выбор вариантов терапии, что и у первичных больных, за исключением, возможно, варианта «наблюдать и ждать». При позднем (более 1 года) небольшом по объему рецидиве можно применять радиотерапию, провести монохимиотерапию (хлорамбуцил, циклофосфан) или полихимиотерапию с или без включения антрациклинов (СОР, АСОР), а также использовать сверхвысокие дозы цитостатиков с трансплантацией аутологичных стволовых гемопоэтических клеток. В случае более резистентного характера течения опухоли применяют полихимиотерапию с включением пуриновых аналогов (флударабин) и высокодозную химиотерапию (ВХТ). Менее агрессивные подходы обладают меньшей эффективностью, но также меньшей токсичностью и затратностью.
Их идеология базируется на двух положениях. Первое положение заключается в отсутствии шанса на полную эрадикацию опухоли на этапе распространенной болезни. Второе же базируется на том факте, что больные могут длительное время (годы и даже десятилетия) существовать с лимфомой без принципиального снижения качества жизни. «Неизлечимость» диссеминированных индолентных лимфом во многом определяется механизмом их патогенеза. В частности, 95% больных с фолликулярными лимфомами имеют транслокацию t (14;28). Эта транслокация приводит к увеличению экспрессии гена bcl-2, продукт которого – белок BCL 2 – оказывает антиапоптотическое действие, определяющее устойчивость к цитостатикам. Поэтому, несмотря на возможность достижения длительной ремиссии, в подавляющем большинстве случаев сохраняется минимальная остаточная опухоль, дающая начало рецидивам. Возвраты заболевания, как правило, отличаются более «злым» характером течения, так как берут начало из клеток лимфомы, максимально устойчивых к химиопрепаратам.
Проведение сверхвысокодозной химиотерапии с аутотрансплантацией стволовых кроветворных клеток, несмотря на значимо более высокую безрецидивную выживаемость, также сопровождается значительным числом возвратов заболевания, и кривая выживаемости не выходит на плато даже через 10 лет. Проведение аллогенной трансплантации, когда к противоопухолевому цитостатическому воздействию добавляется противоопухолевое иммунологическое воздействие (реакция трансплантат против лимфомы), позволяет у 30-40% больных достичь длительной безрецидивной выживаемости. Иммунная система донора способна эффективно разрушать опухолевые клетки, в том числе химиорезистентные. В то же время этот подход является высокотоксичным, затратным и не применимым к большинству больных (отсутствие совместимого донора, пожилой возраст).
В развитии альтернативных донорской трансплантации куративных подходов за последние годы достигнут значительный прогресс. В первую очередь он связан с разработкой моноклональных антител к антигенам В-линейных (анти-CD19, 20, 22) и Т-линейных лимфом (анти-CD3, 52), в том числе конъюгированных с радиоизотопами или токсинами; она позволила получить новый класс препаратов, способных преодолеть лекарственную устойчивость к цитостатикам.
Наиболее исследованным и применяемым из этой группы препаратов является ритуксимаб (Мабтера), представляющий собой гуманизированные (включающие фрагменты человеческих) и мышиные моноклональные антитела к антигену CD20. Этот антиген содержится на мембране всех В-клеток, за исключением самых ранних (пре-В) и самых зрелых (плазматические клетки). Гуманизация антител значительно снижает их иммунногенность, что повышает эффективность и позволяет проводить терапию многократно, не опасаясь выработки нейтрализующих антител.
Соединение ритуксимаба с антигеном на клеточной стенке В-клеток сопровождается, во-первых, активацией комплемента с последующим комплементзависимым лизисом, во вторых, присоединением Fс-рецептора NK клеток к Fc-домену антитела с высвобождением перфоринов, также вызывающих лизис В-клеток и, в-третьих, прямой стимуляцией апоптоза. Препарат практически не имеет гематологической токсичности и, за исключением реакций гиперчувствительности при введении, переносится достаточно хорошо. Это позволяет назначать его многократно, без существенной токсичности и ухудшения качества жизни. Первые же исследования по монотерапии Мабтерой при индолентных лимфомах показали эффективность препарата у первичных больных и, что особенно важно, значимый эффект был достигнут у больных с рецидивами и резистентными формами заболевания. Наибольшая эффективность достигнута у больных с ФЛ (60%). Средняя продолжительность ответа составила 11 месяцев. Определение гиперэкспрессии bcl-2 в лимфоидных клетках методом полимеразной цепной реакции (суррогатный маркер минимальной остаточной болезни) показало полное исчезновение этого признака в лимфоидных клетках через год после терапии из костного мозга у 50% и из периферической крови – у 80% исследованных пациентов. У больных с молекулярной ремиссией (отсутствие гиперэкспрессии с bcl-2) длительность эффекта была практически в 2 раза больше, чем у больных в ремиссии, но сохраняющих гиперэкспрессию с bcl-2 хотя бы в части лимфоидных клеток. Увеличение числа инфузий Мабтеры до 8 и поддерживающая терапия Мабтерой в ремисии позволили значительно увеличить как число клинических полных ремиссий (с 5-9% до 15-18%), так и их продолжительность.
Больные, рецидивировавшие после начально успешного применения Мабтеры, сохраняли чувствительность к препарату и при повторном, и при третьем введении без существенного нарастания токсичности. Эффективность повторного введения была значимо выше, чем первого: общая эффективность составила 93% при 42% полных ремиссий и более длительной безрецидивной выживаемости.
Многие цитостатики способны усиливать эффект Мабтеры. Так, флударабин приводит к понижающей регуляции ингибиторов комплемента и таким образом усиливает комплементзависимый лизис опухолевых клеток, вызываемый Мабтерой. Мабтера, в свою очередь, повышает чувствительность лимфомных клеток ко многим цитостатикам (доксорубицин, идарубицин, этопозид, цисплатин) и глюкокортикоидам (дексаметазон). Совместное (конкурентное) назначение цитостатиков и Мабтеры приводит к индукции полной ремиссии значительно чаще, чем их последовательное назначение.
В нескольких исследованиях добавление Мабтеры к режимам СОР (CVP) и АСОР (СНОР) в первой линии химиотерапии пациентов с фолликулярными лимфомами значимо увеличивало безрецидивную (медиана 34 месяца против 15 месяцев, р=0,0001) и общую выживаемость (4-летняя общая выживаемость 90% против 81%, р=0,039). В большей степени различие между группами отмечались у пациентов, дополнительно получающих Мабтеру в виде поддерживающего лечения в течение 1-2 лет. Эти результаты привели к тому, что курсы химиотерапии с Мабтерой R-CVP, R-CHOP с поддерживающей терапией Мабтерой стали стандартом лечения распространенных фолликулярных лимфом.
Комбинация флудрабина, митоксантрона и циклофосфамида (FCM) является эффективным режимом химиотерапии у больных с рефрактерным/рецидивирующим течением индолентных лимфом. В контролируемом рандомизированном исследовании по изучению лимфом, включившем 147 больных (54% с фолликулярной лимфомой и 34% – с мантийноклеточной), было осуществлено назначение химиотерапи по схеме FCM с или без совместного назначения Мабтеры. Частота полных ремиссий (33 и 13%) и общая частота ремиссий (79 и 58%) были значимо выше в группе больных, получавших Мабтеру. Гематологическая и негематологическая токсичность были практически одинаковы у обоих режимов. По мнению немецких экспертов, режим химиотерапии по схеме FCM с добавлением Мабтеры может считаться стандартом лечения для больных с фолликулярной или мантийноклеточной лимфомой, у которых имели место рецидивы или резистентность к режимам химиотерапии типа СНОР. Аналогичное по схеме химиотерапии исследование было проведено у больных с рецидивами мантийноклеточной лимфомы. Добавление Мабтеры значительно увеличило частоту полных ремиссий (33 против 0%) и общую долю больных с полной или частичной ремиссией (62 против 43%). Самое важное, что в этой работе было отмечено увеличение продолжительности жизни больных, получавших Мабтеру. При медиане наблюдения около 2 лет в живых оставались 16 из 24 больных в группе Мабтеры (67%) против 8 из 24 (33%) в группе сравнения, р=0,0042.
Использование ВХТ для лечения рецидивов и резистентных форм индолентных лимфом до последнего времени было одним из приемлемых, но редко используемых вариантов лечения. С одной стороны, ВХТ позволяла достичь наибольшего числа полных ремиссий, в том числе у больных, резистентных к стандартной химиотерапии. С другой стороны, этот метод не приводил к излечению (отсутствие плато на кривой безрецидивной выживаемости), был более дорогостоящим и токсичным. Опубликованные недавно результаты контролируемых исследований при фолликулярных лимфомах свидетельствуют о преимуществе ВХТ над стандартными методами лечения. Достигнуто значимое увеличение не только безрецидивной, но и общей выживаемости.
Использование Мабтеры в режимах ВХТ теоретически может улучшить результаты лечения. Мабтера не увеличивает гемотологическую токсичность, не сокращает количества полученных стволовых клеток и может приводить к эрадикации минимальной остаточной болезни. Начальные исследования свидетельствуют о высокой эффективности такого подхода. Использование Мабтеры с ВХТ в небольшом сравнительном исследовании (Buckstein, 2002) у 49 пациентов с рецидивирующим/ резистентным течением фолликулярной лимфомы оказалось эффективным. В этом исследовании в 3 группах больные, помимо ВХТ, получали либо интерферон как поддержку после трансплантации, либо Мабтеру до и после ВХТ, либо Мабтеру до и Мабтеру с интерфероном после химиотерапии. Частота полных ремиссий через 3 месяца после трансплантации составила 23% для больных, получавших только интерферон, 90% для больных, получавших только Мабтеру, и 70% для больных, получавших интерферон с Мабтерой в консолидации. Десять из 12 больных в группе Мабтеры продолжали сохранять молекулярную ремиссию в течение 2-3 лет. Еще одно аналогичное исследование, проведенное на материале больных с фолликулярной и диффузной крупноклеточной лимфомой, также показало высокую эффективность сочетания Мабтеры с ВХТ.
В аналогичном по схеме терапии исследовании в группе из 28 пациентов с мантийноклеточными лимфомами (Gianni, 2002) полная ремиссия была достигнута у 27 (96%) и молекулярная у 100% (из 20 обследованных) больных. Безрецидивная выживаемость на протяжении трех лет в группе получивших ВХТ с Мабтерой была значительно выше, чем у больных исторического контроля, получавших стандартную химиотерапию типа CHOP (соответственно 80 и 20%).
Небольшое исследование с использованием ВХТ и Мабтеры было проведено у больных с ХЛЛ, не получавших химиотерапию или рецидивировавших не более 1 раза. Проведение 4 курсов химиотерапии флударабином и циклофосфаном, одного курса ESHAP (этопозид, цитарабин, цисплатин и дексаметазон) со сбором стволовых клеток и ВХТ по схеме ВЕАМ позволило добиться полной клинической и молекулярной ремиссии у 7 из 8 больных, закончивших лечение.
Агрессивные лимфомы
Неходжкинские лимфомы высокой и промежуточной степени злокачественности, как правило, высоко чувствительны к химио- и радиотерапии. Режим химиотерапии первой линии СНОР (доксорубицин, циклофосфамид, винкристин и преднизолон), остающийся стандартом лечения в этой группе больных, позволяет достичь 40-60% полных ремиссий. В то же время у 25-35% пациентов отмечаются рецидивы после начального успеха. Таким образом, больше половины больных с агрессивными неходжкинскими лимфомами либо не отвечают на начальную химиотерапию, либо рецидивируют.
За последние 5 лет в лечении лимфом произошли значительные изменения. Режим химиотерапии СНОР перестал быть стандартом первой линии лечения у большинства больных с лимфомами высокой и промежуточной степени злокачественности. Германская группа по изучению лимфом (DSHNHL) провела исследование, направленное на «модернизацию» классического режима СНОР. В это исследование было включено 1399 больных с НЛ, которые были разделены на 4 группы. В первой группе назначался стандартный режим СНОР каждые 3 недели, во второй этот режим использовался каждые 2 недели, в третьей каждые 3 недели применялся режим СНОР с этопозидом (СНОЕР) и в четвертой режим СНОЕР применялся каждые 2 недели. Двухнедельные интервалы поддерживались за счет планового назначения гранулоцитарного колониестимулирующего фактора (ГКСФ). Анализ результатов проводили отдельно в подгруппах старше и младше 60 лет. Использование метода «dose density», когда за счет назначения ГКСФ укорачивались интервалы между стандартными циклами СНОР со стандартных 21 дня до 14 дней, показало увеличение эффективности лечения у больных старше 60 лет. Общая пятилетняя выживаемость составила для стандартного и интенсивного режима соответственно 40,6 и 53,3% (р>0,001). Добавление этопозида к режиму СНОР несколько увеличило общую выживаемость у пациентов моложе 60 лет в сравнении с результатами стандартной химиотерапии (69,2 против 57,6%; р=0,004). В то же время укорочение интервалов между курсами и добавление этопозида значимо увеличили токсичность лечения.
В последние годы для лечения агрессивных В-клеточных лимфом широко стали использоваться моноклональные антитела к антигену CD20 – ритуксимаб (Мабтера). В рандомизированном исследовании LNH-98.5 у пожилых больных с диффузной крупноклеточной В-клеточной лимфомой проведение химиотерапии СНОР позволило добиться полной ремиссии у 62% больных, а использование комбинации СНОР + ритуксимаб – у 76% больных. Двухлетняя бессобытийная выживаемость пациентов, получивших комбинацию СНОР + ритуксимаб, была статистически значимо выше, чем у получивших только СНОР (62 и 44% соответственно). При этом миелотоксичность значимо не различалась между группами. Инфекционные осложнения (за исключением герпетических проявлений) также отмечались с равной частотой, составив около 65% в обеих группах. Проведение аналогичного исследования в группе больных моложе 60 лет также подтвердило преимущество комбинирования Мабтеры с режимом СНОР.
Недавно закончено исследование, пытающееся объединить преимущество СНОР14 и R-CHOP. Предварительные результаты свидетельствуют о том, что добавление ритуксимаба к режиму СНОР14 значимо улучшает результаты лечения. Режим R-СНОР14 может стать новым стандартом лечения диффузной крупноклеточной В-клеточной лимфомы.
Помимо достижений в лечении агрессивных лимфом, улучшились результаты их диагностики. С появлением позитронно-эмиссионной томографии (ПЭТ) значительно возросла точность стадирования и оценки эффекта, особенно в случае частичной ремиссии и сохранения остаточной опухоли. Кроме того, достигнуты успехи в изучении профиля экспрессии генов при различных вариантах НЛ, что позволило выявить новые факторы прогноза, не учитываемые международным прогностическим индексом.
Использование ПЭТ-сканирования позволяет выявить больных с высоким риском рецидива лимфомы. В работе Spaepеn был проведен анализ течения заболевания 96 больных с лимфомами высокой и промежуточной степени злокачественности в зависимости от результатов ПЭТ исследования по окончании лечения. Среди 67 больных с негативным результатом 80% длительное время находились в ремиссии, а у 20% наблюдался рецидив, и медиана времени до его развития составляла около 2 лет. Среди 29 больных с позитивным результатом ПЭТ-сканирования рецидив наблюдался в 100% случаев при медиане около 4 месяцев. В некоторых исследованиях показана еще большая прогностическая значимость этого исследования, если оно проводилось на раннем этапе – после первого или второго курса химиотерапии. В то же время сегодня нет данных о том, что ранняя интенсификация химиотерапии в этих случаях может улучшить общий прогноз, и проведение подобных исследований – вопрос будущего.
Одним из факторов, определяющих целесообразность проведения ВХТ в группе больных с лимфомами, является уровень риска по международному прогностическому индексу (IPI). В то же время исследование активности генов с использованием микрочипов позволяют в общей группе диффузных В-клеточных крупноклеточных лимфом выделить подгруппы лимфом из клеток герминального и негерминального центров. По некоторым данным, больные с лимфомами из клеток, прошедших герминальный центр (активированных лимфоцитов), имеет более низкую общую и безрецидивную выживаемость независимо от величины IPI. В одном из исследований были проанализированы результаты ВХТ у 86 больных с рецидивами ДККЛ в зависимости от результатов генетического исследования образцов лимфомы, полученных при рецидиве опухоли. Авторами не было выявлено различий в показателях выживаемости между лимфомами из герминального и не из герминального центра. Продолжаются дополнительные исследования в этом направлении.
В то же время все эти подходы полностью не решили проблемы резистентных случаев и рецидивов агрессивных неходжкинских лимфом, составляющих до 30-50% случаев. Недостаточная эффективность стандартных режимов второй линии заставила исследователей интенсифицировать цитостатическую терапию и, в частности, применять ВХТ с трансплантацией костного мозга. Первые исследования по ВХТ, проводимые в рамках отдельных центров в 1980-1990 гг., свидетельствовали о значительном эффекте этого типа лечения. Мабтера теоретически может применяться на всех этапах ВХТ: совместно с реиндукционной химиотерапией второй линии, в процессе сбора стволовых клеток, перед введением цитостатиков в высокой дозе и в посттрансплантационном периоде. Каждый из этих подходов имеет определенные обоснования.
В нескольких работах изучалась эффективность Мабтеры у больных с диффузной крупноклеточной лимфомой после окончания ВХТ. В исследовании Horwitz 25 больным, большинство из которых (80%) получили ВХТ в связи с рецидивами или первичной резистентностью, было осуществлено 4 введения Мабтеры с недельным интервалом, начиная с 42-го дня после трансплантации. Общая (88%) и безрецидивная (83%) выживаемость 2 года, по мнению авторов, превышает аналогичные показатели исторического контроля данного центра для аналогичной группы больных, составляющие соответственно 62 и 58%.
Назначение Мабтеры некоторыми авторами проводилось как до ВХТ, так и непосредственно перед введением цитостатиков в высоких дозах. Во всех этих исследованиях была подтверждена безопасность назначения Мабтеры. В одном из протоколов Anderson Мабтера вводилась на четырех этапах, включая реиндукционную химиотерапию, сбор стволовых клеток, ВХТ и ранний посттрансплантационный период. Результаты применения этой схемы у 67 пациентов (41 с ДККЛ и 26 с фолликулярной лимфомой III цитологического типа или трансформированной) сравнивались с историческим контролем. При медиане наблюдения в 20 месяцев расчетная 2-летняя общая выживаемость составила 80% для группы ритукcимаба и 53% для группы контроля (р=0,002). Выживаемость без опухоли составила соответственно 67 и 43% (р=0,004).
Наши данные включают результаты наблюдения 22 больных с В-клеточными лимфомами (17 ДККЛ) и крайне неблагоприятным прогнозом (резистентный рецидив, первичная резистентность). Пациенты получали ритуксимаб на этапах индукционной химиотерапии, перед сбором аутологичных стволовых клеток и ВХТ, а также в посттрансплантационном периоде. После окончания терапии проводилось облучение остаточной опухоли или областей исходного массивного опухолевого поражения. Использование ритуксимаба на различных этапах лечения больных с В-клеточными лимфомами привело к статистически значимому улучшению общей выживаемости в сравнении с историческим контролем. В группе больных с В-клеточными опухолями, не получавших Мабтеру, 5-летняя общая выживаемость составила 21%, получавших Мабтеру – 52% (р=0,037). Различие в выживаемости сохранилось и после исключения из анализа больных с индолентными лимфомами (р=0,014). Токсичность лечения была сопоставима в обеих группах.
 Доктор медицинских наук, старший научный сотрудник отдела гематологии и трансплантологии НЦРМ АМН Украины Ирина Анатольевна Крячок посвятила свой доклад проблеме диагностики и лечения НЛ в Украине.
Доктор медицинских наук, старший научный сотрудник отдела гематологии и трансплантологии НЦРМ АМН Украины Ирина Анатольевна Крячок посвятила свой доклад проблеме диагностики и лечения НЛ в Украине.
– К сожалению, в настоящее время проблем у украинской онкогематологии больше, чем достижений. Это относится и к терапии НЛ. В нашей стране отсутствует адекватный учет онкогематологической заболеваемости. Статистические исследования в этом направлении в Украине проводят только в Институте онкологии АМН Украины (г. Киев) и Институте патологии крови и трансфузионной медицины АМН Украины (г. Львов), при этом данные по заболеваемости лимфомами, предоставляемые ими, существенно отличаются. В большинстве областей Украины больные НЛ наблюдаются в онкологических диспансерах, к гематологам они попадают на прием уже в стадии лейкемизации.
Достаточно серьезную проблему представляют вопросы классификации лимфом. Во всем мире онкогематологи используют классификацию ВОЗ 2001 г., тогда как в Украине – классификацию ВОЗ 1988 г., что не может не сказаться на статистических данных. Кроме того, врачи очень часто забывают указывать стадию заболевания.
Своевременная и адекватная диагностика заболевания является непременным условием успешного лечения. Тактика терапии больных НЛ должна основываться на результатах иммуногистохимического исследования, которое в Украине проводят только три лаборатории: лаборатория патологической гистологии Киевской городской онкологической больницы, цитоморфологическая лаборатория Института неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины (г. Донецк) и диагностический центр Днепропетровской медицинской академии.
За последние 20 лет схемы терапии НЛ существенно изменились. В 80-х – начале 90-х гг. ХХ столетия для лечения этой патологии применялась монотерапия алкилирующими цитостатиками (лейкеран, циклофосфан). С 1990 по 1997 г. для этой цели использовались пуриновые аналоги в режиме полихимиотерапии (СНОР, СНОЕР и др.). С 1997 г. для лечения НЛ в практику была введена высокодозовая полихимиотерапия и трансплантация костного мозга, а 2002 г. можно считать началом новой эры в терапии этих заболеваний – эры моноклональных антител.
В Украине препараты моноклональных антител, в частности ритуксимаб (Мабтера), применяются с 2004 г. В этом году врачи уже 12 областных центров Украины имели возможность на практике оценить высокую эффективность этого препарата. К сожалению, в Украине пациентов, получающих Мабтеру, очень мало – немногим более 50 человек за 3 года. Для сравнения: в Польше ритуксимаб ежегодно получают 700 пациентов (из 39 млн жителей), в Эстонии – 90 больных в год (из 1 млн населения), в России – более 2 тыс. человек ежегодно (при численности населения 140 млн человек).
Хотелось бы представить результаты, полученные в украинских клиниках в ходе лечения 44 пациентов с НЛ II-IV стадий с помощью Мабтеры. В исследование были включены 17 женщин и 27 мужчин; лиц до 30 лет – 4%, 30-50 лет – 26%, старше 50 лет – 70%. Половина больных получала ритуксимаб в дозе 700 мг в одно введение, 14% – 500 мг (что ниже минимальной рекомендуемой дозы), 26% – 600 мг и 10% – 900 мг. Рекомендуемые 5-6 введений препарата получили 23% пациентов, 3-4 введения – 42%, только 1-2 введения – 35%. Состояние ремиссии было достигнуто у 67% больных, у 10% отмечались рецидивы, у 7% – прогрессирование заболевания, 16% за период наблюдения умерли.
В заключение отметим, что для результативной терапии НЛ в Украине необходимо:
- внедрение стандартов диагностики лимфом в общеклиническую практику;
- координация деятельности всех специалистов (гистолог, гематолог, онколог, врач функциональной диагностики);
- создание центра лимфопролиферативных заболеваний;
- создание национальной программы лечения лимфопролиферативных заболеваний;
- финансирование этой программы;
- акцентирование на роли гематолога в терапии лимфом;
- создание и усовершенствование диагностических лабораторий;
- создание региональных референтных лабораторий.
Для адекватной терапии НЛ Мабтерой необходимо:
- обязательное выполнение иммуногистохимического исследования перед началом лечения;
- назначение рекомендуемых расчетных доз – 375 мг/м2;
- соблюдение режима применения Мабтеры – минимум 4-6 введений;
- проведение терапии НЛ на ранних стадиях;
- внедрение в практику поддерживающей терапии.
Подготовила Наталья Мищенко
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Лимфома крови
Лимфома крови
 ЧТО НОВОГО В КАРДИОЛОГИИ И РЕВМАТОЛОГИИ? обзор клинических исследований
ЧТО НОВОГО В КАРДИОЛОГИИ И РЕВМАТОЛОГИИ? обзор клинических исследований
 Клиническая инфектология и паразитология. Часть 1
Клиническая инфектология и паразитология. Часть 1
 Клиническая инфектология и паразитология. Часть 5
Клиническая инфектология и паразитология. Часть 5