Хроническая крапивница: новый взгляд на патогенез, современные подходы к лечению
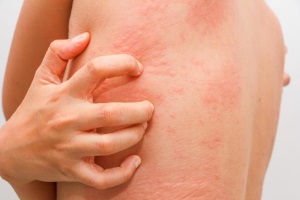
Крапивница представляет собой одно из наиболее распространенных аллергических заболеваний, которому подвержены люди любого возраста. Отмечено, что около 15-20% населения нашей планеты хотя бы один раз в жизни переносят эпизод крапивницы (Е.С. Феденко, 2000).
Актуальность этой патологии определяется не только ее распространенностью, но и необходимостью проведения широкого комплекса диагностических мероприятий, наличием значительной группы больных с неуточненной этиологией заболевания, отсутствием унифицированных лечебно-диагностических подходов, а также необходимостью длительного, порой пожизненного применения лекарственных средств при лечении хронических форм.
Определение и классификация
Крапивница представляет собой своеобразную, чаще аллергическую реакцию в ответ на различные раздражители и может являться единственным проявлением патологического процесса или одним из признаков какого-либо заболевания. С учетом течения выделяют острую и хроническую крапивницу. Острая крапивница характеризуется продолжительностью заболевания менее 6 нед, хроническая – более 6 нед.
Причину острой крапивницы удается установить у половины пациентов. В большинстве случаев в основе патогенеза острой крапивницы лежат IgE-опосредованные реакции, а основными причинными факторами являются пищевые продукты и лекарственные препараты, реже – укусы насекомых, холод, солнечный свет, тепло. Острой формой крапивницы чаще страдают лица молодого возраста.
Распространенность хронической крапивницы составляет 0,1% в популяции (M.W. Greaves, R.A. Sabroe, 1998). Хронической крапивницей страдают преимущественно лица трудоспособного возраста, дебют заболевания чаще приходится на второе и четвертое десятилетие жизни.
Этиология и патогенез хронической крапивницы
Ранее считалось, что хроническая крапивница в 80-95% случаев является идиопатической (R.H. Champion, 1988). В последнее время этиология и патогенез этого заболевания пересмотрены. В зарубежной медицинской литературе все реже находим термин «идиопатическая крапивница», более распространенным стало определение «хроническая крапивница». Связано это с тем, что в процессе многолетнего наблюдения за больными с ранее установленным диагнозом «идиопатическая крапивница» многие исследователи выявляли аутоиммунный генез заболевания (M. Hide et al., 1993). При хронической крапивнице в сыворотке крови больных определяются аутоантитела (IgG) к высокоаффинным рецепторам IgE на тучных клетках. Эти аутоантитела обладают способностью непосредственно вызывать дегрануляцию тучных клеток.
Клинические симптомы аутоиммунной крапивницы практически не отличаются от клинической картины хронической крапивницы, при которой отсутствуют данные аутоантитела (R.A. Sabroe et al., 1999). Однако выявление аутоиммунной крапивницы является крайне важным для определения тактики ведения этих пациентов, т. к. основными методами лечения, индуцирующими ремиссию у больных с аутоиммунной крапивницей, являются плазмаферез, внутривенное введение иммуноглобулина, применение циклоспорина А и глюкокортикостероидов (C.E. Grattan et al., 1992; O'Donnell B.F., et al., 1998). Скрининговым методом для выявления аутоиммунной крапивницы является постановка кожного теста с аутологичной сывороткой (R.A. Sabroe, C.E. Grattan et al., 1999).
Хорошо известен тот факт, что аутоиммунные заболевания часто сопутствуют хронической крапивнице. В 1983 году Leynoff опубликовал данные, свидетельствующие о высокой частоте аутоиммунного тиреоидита среди пациентов, страдающих хронической крапивницей (особенно у женщин), при этом в сыворотке крови у многих пациентов могут присутствовать антимикросомальные антитела, даже если у них наблюдается клиническая картина эутиреоза (A. Leznoff et al., 1983).
Считается, что пищевые добавки (красители, приправы и консерванты) выступают в качестве этиологических факторов при хронической крапивнице и реализуют свое действие через неиммунологические механизмы (M.W. Greaves, R.A. Sabroe, 1998). Крапивница также может быть симптомом бактериальной, вирусной или грибковой инфекции. Кроме того, эта патология может быть симптомом системного заболевания, поэтому взрослые пациенты должны обследоваться на предмет системных коллагенозов (системная красная волчанка, синдром Шегрена, ревматоидный артрит), поскольку эти заболевания могут сопровождаться высыпаниями, внешне не отличимыми от крапивницы. Имеются сообщения о взаимосвязи крапивницы с болезнью Ходжкина, злокачественными опухолями толстой кишки, печени, легких и яичников (M.H. Anderson et al., 1990). Результаты проспективных исследований дают основания предполагать, что больные с крапивницей в анамнезе, возможно, относятся к группе повышенного риска по развитию лейкемии, лимфомы или миеломы (W.P. McWorter, 1988).
Уртикарные элементы при хронической крапивнице обусловлены местным повышением проницаемости сосудов кожи, преимущественно посткапиллярных венул. Формирование волдырей при хронической идиопатической крапивнице происходит вследствие нежелательной активации тучных клеток кожи, приводящей к высвобождению гистамина и других медиаторов. Медиаторы, высвобождаемые из тучных клеток кожи, вызывают повышение проницаемости сосудов кожи, а также гиперемию и зуд. Ведущая роль в патофизиологическом механизме хронической крапивницы принадлежит гистамину. Гистамин, хранящийся в гранулах тучных клеток и высвобождаемый в результате дегрануляции, является основным медиатором, что доказывается клинической эффективностью блокаторов Н1-гистаминовых рецепторов при лечении хронической крапивницы (M.W. Greaves, R.A. Sabroe, 1996).
Клиническая картина
Основным клиническим симптомом крапивницы являются эритематозные зудящие волдырные элементы, четко отграниченные, возвышающиеся над поверхностью кожи, размером от нескольких миллиметров до нескольких сантиметров, которые присутствуют постоянно, меняя локализацию, или возникают в виде рецидивов продолжительностью более 6 мес.
Такие стойкие клинические симптомы не представляют угрозы для жизни пациента, однако могут приводить к утрате трудоспособности и существенно ухудшать качество жизни больных, вызывая значительный дискомфорт. У них отмечают нарушения сна, повседневной активности, расстройства эмоциональной сферы, стремление к социальной изоляции, что связано с косметическими дефектами. Наибольшее беспокойство вызывает зуд кожи. Результаты последних исследований свидетельствуют о том, что влияние симптомов хронической крапивницы на больного сопоставимо с таковыми проявлений ишемической болезни сердца (B.F. O'Donnell, 1997).
Принципы лечения
В лечении хронической крапивницы следует обращать внимание на такие основные моменты:
- установление этиологических факторов, их элиминация;
- купирование обострения (антигистаминные, глюкокортикостероиды, дезинтоксикация);
- подбор базисной терапии (антигистаминные, глюкокортикостероиды, противовоспалительные, антиоксиданты и т. п.);
- лечение этиологически значимой сопутствующей патологии;
- профилактические мероприятия.
В большинстве случаев средствами первого выбора в лечении больных с хронической крапивницей считают антигистаминные препараты. Они воздействуют на Н1-гистаминовые рецепторы посткапиллярных венул кожи, тем самым устраняя индуцированные гистамином вазодилатацию и повышение проницаемости сосудов.
Первое поколение антигистаминных препаратов (дифенгидрамин, хлоропирамин, клемастин, прометазин, мебгидролин, диметинден, ципрогептадин и др.), является конкурентными блокаторами Н1-рецепторов, и потому связывание их с рецептором происходит быстро и носит обратимый характер. В связи с этим для достижения основного фармакологического действия требуются высокие дозы таких антагонистов, при этом чаще и интенсивнее проявляются их побочные свойства. Кроме того, кратковременность действия этих препаратов требует их многократного применения в течение суток.
Антигистаминные препараты первого поколения в терапевтических дозах оказывают блокирующее действие и на рецепторы других медиаторов, что объясняет связанные с их применением нежелательные побочные эффекты:
- антихолинергическое действие (уменьшение экзогенной секреции, повышение вязкости секретов, что проявляется сухостью слизистых оболочек полости рта, носа, горла, иногда расстройство мочеиспускания и ухудшение зрения);
- центральная холинолитическая активность (седативное и снотворное действия, нарушение координации движений, головокружение, вялость, снижение концентрации внимания, усиление действия депрессантов ЦНС);
- потенцирование эффекта катехоламинов (колебания АД);
- местное анестезирующее действие;
- расстройства желудочно-кишечного тракта (тошнота, рвота, диарея, потеря аппетита, неприятные ощущения в эпигастрии);
- тахифилаксия (снижение терапевтического действия при длительном применении).
Так возникла необходимость создания антигистаминных препаратов, которые имели бы высокое сродство к Н1-рецепторам и высокую избирательную активность, не взаимодействуя с другими медиаторными системами. Эта цель была достигнута в конце 70-х годов прошлого века, когда были созданы антагонисты Н1-рецепторов нового поколения (терфенадин, цетиризин, астемизол, лоратадин, эбастин и некоторые другие), которые соответствовали заданным фармакологическим свойствам, надежно блокировали Н1-рецепторы и могли использоваться однократно в сутки.
Многие Н1-антагонисты последнего поколения связываются с рецепторами неконкурентно. Такие соединения с трудом вытесняются из рецептора, чем объясняется их продолжительное действие. Препараты второго поколения, в отличие от своих предшественников, не обусловливают большого количества побочных эффектов, в частности не оказывают или оказывают крайне незначительное седативное воздействие, не проникают через гематоэнцефалический барьер в терапевтических дозах. При этом отсутствует связь абсорбции с приемом пищи и явление тахифилаксии.
Названные средства начали широко применять врачи-аллергологи и другие специалисты, эти препараты стали весьма популярны во всем мире, в т. ч. в нашей стране. В Украине широко известен лоратадин, но он, как и некоторые другие средства антигистаминных препаратов второго поколения, имеет определенные ограничения, связанные с его применением в сочетании с лекарственными средствами (макролиды, кетоконазол и некоторые другие).
Именно поэтому встал вопрос о необходимости совершенствования и этой группы препаратов. Большинство из них представляют собой пролекарства, т. е. при поступлении в организм человека подвергаются метаболизму и лишь конечные продукты оказывают основное фармакологическое действие – осуществляют блокаду Н1-рецепторов. Если по какой-либо причине метаболизм лекарственного средства оказывается нарушенным, происходит накопление исходного продукта, который может обладать нежелательными эффектами. Именно это произошло с терфенадином и астемизолом, которые при превышении рекомендованных терапевтических доз или нарушении метаболизма, вследствие поражения печени, либо при сопутствующем приеме препаратов, угнетающих активность ферментов, участвующих в превращении указанных пролекарств в конечные метаболиты, вызывали нарушения сердечного ритма, в некоторых случаях – со смертельным исходом.
Оптимальным направлением работы по улучшению профиля антигистаминных препаратов явилось создание лекарственных средств на основе фармакологически активных конечных метаболитов препаратов второго поколения. Они должны были сохранить все преимущества своих предшественников и при этом не оказывать побочного влияния на сердечно-сосудистую систему, а также не взаимодействовать с препаратами, угнетающими систему цитохрома Р450. Первым антигистаминным средством, крайне незначительно подвергающимся метаболизму, был цетиризин (Аналергин).
Аналергин – в лечении хронической идиопатической крапивницы
По мнению A. Pagliara (Швейцария), цетиризин следует считать антигистаминным препаратом III поколения в связи с его особой фармакокинетикой и фармакодинамикой.
Антигистаминное действие цетиризина начинает проявляться очень быстро – через 30 мин после приема препарата per os, а его концентрация в крови достигает максимума в течение 1 ч. Цетиризин быстро всасывается из пищеварительного тракта, хорошо связывается с белками крови, плохо – с тканями головного мозга, т. к. имеет низкую липофильность. При курсовом приеме препарата постоянный уровень в крови достигается в течение 3 сут, при регулярном приеме не наступает его аккумуляция и не изменяется скорость элиминации (курс лечения до 8 нед).
Уникальными свойствами Аналергина (цетиризина) является его способность ингибировать инфильтрацию эозинофилами – ключевыми клетками аллергического ответа поздней фазы, что усиливает его клинический эффект.
Большинство блокаторов H1-гистаминовых рецепторов метаболизируются в печени изоферментом системы цитохрома Р450. В человеческой популяции существует значительная вариабельность экспрессии этого фермента, который ответствен за 10-60% общей активности этой системы. Метаболический фактор имеет решающее значение при одновременном использовании препаратов, влияющих на систему цитохрома Р450. Серьезные последствия могут возникать при единовременном применении макролидов, таких как эритромицин и кларитромицин, противогрибковых производных имидазола (кетоконазола, итраконазола), других медикаментов, пищевых компонентов (нарин-генин в соке грейпфрута), которые тормозят оксигеназную активность ферментов системы цитохрома Р450. В такой ситуации неметаболизированная исходная форма препарата накапливается в крови и ткани сердца, что может привести к удлинению интервала QT на ЭКГ и нарушению желудочкового ритма вплоть до желудочковой веретенообразной тахикардии.
Цетиризин, в отличие от других антигистаминных препаратов II поколения, крайне незначительно подвергается метаболизму. Это дает возможность сочетать его с антибиотиками, противогрибковыми и другими препаратами.
Период полуэлиминации цетиризина составляет 7-11 ч (у взрослых после приема 10 мг препарата). У пожилых лиц этот показатель несколько длиннее (11,8 ч), что связано с уменьшением клиренса и зависит не от возраста, а от функции почек – при ее нарушении период полувыведения соответствует 20 ч, при нарушении функции печени – 13,8-14,3 часа. Цетиризин выделяется преимущественно почками, поэтому показан прежде всего у больных с заболеваниями печени.
Для цетиризина характерна высокая способность проникновения в кожу. Через 24 часа после приема однократной дозы концентрация цетиризина в коже оказывается равной или даже несколько превышающей концентрацию в крови. В двойном слепом плацебо контролируемом рандомизированном перекрестном сравнительном исследовании J.A. Grant et al. установлено, что цетиризин более эффективно подавляет волдырь и уменьшает гиперемию, вызванные введением гистамина, и действует более длительно по сравнению с фексофенадином, эбастином, эпинастином, терфенадином и лоратадином.
Таким образом Аналергин является эффективным и безопасным противогистаминным средством, что позволяет с успехом применять его для лечения хронической крапивницы, кожных аллергозов, сезонного и круглогодичного аллергического ринита, аллергического конъюнктивита, других заболеваний. Положительные свойства цетиризина, такие как незначительный метаболизм в печени, скорость наступления эффекта, высокая антигистаминная активность на коже, являются залогом успешного его применения в клинической практике.
Подготовила Наталья Мищенко
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Аллергический кашель
Аллергический кашель
 Лекролин® в лечении аллергических заболеваний глаз
Лекролин® в лечении аллергических заболеваний глаз
 Аллергический ринит
Аллергический ринит
 Сезонные аллергические риноконъюнктивиты: распространенность, методы диагностики и лечения
Сезонные аллергические риноконъюнктивиты: распространенность, методы диагностики и лечения