- Головна
- /
- Статті
- /
- Отоларингологія
- /
- Полипоз носа: клеточный подход к ответам на вопросы
Полипоз носа: клеточный подход к ответам на вопросы
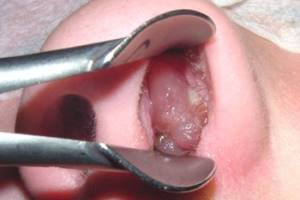
Полипоз носа – распространенное хроническое воспалительное заболевание слизистой оболочки носа, которое значительно влияет на качество жизни пациентов. Эта патология характеризуется доброкачественным ростом ткани слизистой оболочки, происходящей из околоносовых пазух, чаще всего из переднего решетчатого комплекса [1].
По мере роста полип опускается в полость носа между средней носовой раковиной и латеральной стенкой, при этом обусловливая развитие таких симптомов, как заложенность носа, ринорея, гипосмия и чувство давления [2].
Лечение кортикостероидами облегчает симптомы, но методов излечения от полипоза не существует. Часто больным требуются повторные операции, которые, наряду с симптоматикой заболевания, значительно ухудшают качество жизни пациентов [3, 4]. Использование универсальных (не зависящих от характера заболевания)
опросников (SF-36) показало, что качество жизни у лиц c полипозом носа хуже, чем у больных с артериальной гипертензией, мигренью, стенокардией, злокачественными опухолями головы и шеи. Ухудшение качества жизни пациентов с полипозом носа сравнимо с таковым больных, страдающих хроническими обструктивными заболеваниями легких [5].
Этиология полипоза носа неизвестна. Хотя и существуют гипотезы о возможной роли микроорганизмов в этиологии этого заболевания, поиск соответствующих эффективных методов лечения до сих пор не увенчался успехом.
Цель этого обзора – обсуждение некоторых проблем и ошибок в изучении полипоза носа, а также определение клеточных факторов и механизмов, наиболее важных для патофизиологии данного состояния. Хотелось бы также предложить потенциально значимые направления для дальнейшего изучения этой проблемы. Понимание патогенеза полипоза носа поможет раскрыть новые терапевтические возможности в лечении этого сложного заболевания.
Трудности в изучении полипоза носа
Фундаментальное изучение патогенеза полипоза носа осложнено двумя проблемами. Во-первых, неизвестно, как многочисленные клинические разновидности (фенотипы) заболевания соотносятся с его патогенезом. Во-вторых, неясно, следует ли считать полипоз носа местным заболеванием или локальным проявлением какой-то системной патологии.
При назальном полипозе описано множество сопутствующих заболеваний, при которых частота полипоза выше, чем в общей популяции. В общей популяции распространенность полипоза носа составляет 0,5-4,3%, что делает эту патологию одним из наиболее часто встречающихся хронических заболеваний верхних дыхательных путей. Частота полипоза носа возрастает у больных бронхиальной астмой (7-15%), муковисцидозом (39-56%),
а также при непереносимости аспирина (36-96%). Интересно, что хотя частота полипоза возрастает при бронхиальной астме, такой тенденции нет у пациентов с аллергическим ринитом, у которых частота этого заболевания не отличается от его распространенности в общей популяции (0,5-4,5%) [2, 6]. Хронический риносинусит также почти всегда сопровождается полипозом носа, хотя обратное несправедливо: только у 20% пациентов с хроническим риносинуситом развиваются назальные полипы [7]. Увеличивается количество доказательств того, что хронический риносинусит с полипозом носа и хронический риносинусит без полипоза – это две разные формы заболевания [8, 9].
Поскольку различные клинические фенотипы полипоза носа отчетливо влияют на распространенность заболевания, их нельзя не учитывать. Мы не знаем, является ли полипоз местным проявлением этих коморбидных состояний. Так, при микроскопическом исследовании назальных полипов обнаруживаются изменения, свойственные слизистой оболочке бронхов у пациентов, страдающих бронхиальной астмой. В обоих случаях в образцах тканей отмечаются повреждение эпителия, гиперплазия бокаловидных клеток, утолщение базальной мембраны, увеличение объема внеклеточного матрикса, фиброз и эозинофильное воспаление. Связь между этими двумя заболеваниями стала еще более вероятной, когда было доказано, что выраженность эозинофильного воспаления в ткани назальных полипов больше у лиц
с полипозом носа и бронхиальной астмой по сравнению с пациентами, имеющими назальные полипы, но не страдающими астмой [10-14].
Другое следствие из наличия разных фенотипов полипоза носа – то, что к образованию полипов могут приводить различные механизмы. Полипоз носа – гетерогенное заболевание, что можно проанализировать с помощью изучения отличий и сходств разных коморбидных состояний. Нужно быть очень осторожными при интерпретации результатов экспериментальных исследований, в которых различные фенотипы полипоза носа объединены в одну группу, которая сравнивается с контрольной группой (со здоровой слизистой оболочкой носа). Очень сложно или даже невозможно определить, какие факторы могут быть причастными к гетерогенности сопутствующих заболеваний и какие факторы являются ключевыми в развитии полипоза носа. Только будущие эксперименты, дизайн которых будет предусматривать активный поиск отличий и сходств разных фенотипов назального полипоза, смогут пролить свет на вопросы патогенеза этой патологии.
Дискутабелен также вопрос о том, является ли полипоз локальным заболеванием или проявлением системной патологии. Воспалительный процесс значительно варьирует (в отношении эозинофилов, лимфоцитов и др.)
в полипах, в средней и нижней носовых раковинах у одних и тех же пациентов. Это может обозначать и то, что полипоз носа – локальное заболевание, и то, что воспалительный процесс в средней носовой раковине отличен от такового в нижней носовой раковине и, возможно, больше похож на воспалительный процесс в назальных полипах. Это важное открытие, учитывая то, что исследования полипоза носа до сих пор сосредотачивались исключительно на сравнении тканей назальных полипов с образцами тканей нижней носовой раковины здоровых пациентов. Необходимо убедиться, что «здоровая» контрольная ткань в точности соответствует источнику назальных полипов у больного. А поскольку назальные полипы преимущественно развиваются из решетчатой пазухи возле средней носовой раковины, следует полагать, что образцами «здоровой» контрольной ткани должны быть ткани слизистой оболочки этой пазухи или средней носовой раковины. Будущие эксперименты необходимо планировать таким образом, чтобы определить наилучший вариант контрольной ткани.
Клеточный подход к патологическим механизмам полипоза носа
Эозинофильное воспаление: «токсический» источник медиаторов
Ткань полипа инфильтрирована преимущественно
эозинофилами, лимфоцитами, плазмоцитами и тучными клетками [16-19].
Активированные эозинофилы, инфильтрирующие ткань, вырабатывают большое количество токсических белков, таких как эозинофильный катионный белок
(ECP) и главный белок с основными свойствами (MBP). Помимо этих токсических медиаторов, эозинофилы также способны продуцировать множество цитокинов, хемокинов и факторов роста. Например, они вырабатывают интерлейкин (IL)-5, колониестимулирующий фактор роста гранулоцитов и макрофагов (GM-CSF), хемокин RANTES и белок ростового регуляторного онкогена
(GRO)-α [15, 17, 20-23]. Тем самым эозинофилы аутокринным образом продлевают собственную жизнь и способствуют увеличению инфильтрации ткани.
Тем не менее на сегодняшний день неизвестно, какой фактор запускает рекрутирование активированных
эозинофилов в ткань назального полипа. Общеизвестно, что эозинофилия является характерным признаком аллергии. У пациентов с полипозом носа и сопутствующим аллергическим ринитом эозинофилы, судя по всему, привлекаются благодаря высвобождению IL-5 [15]. Однако, согласно предварительным неопубликованным данным, у пациентов с полипозом носа, не страдающих аллергией, астмой и толерантных к аспирину, не выявлено повышения уровня IL-5-продуцирующих клеток. Напротив, при отсутствии аллергии эозинофилы рекрутируются преимущественно под влиянием высвобождения GM-CSF [15]. Как бы то ни было, в итоге
эозинофильная инфильтрация ткани оказывается сравнимой при атопическом и неатопическом полипозе носа [24-27]. Различия наблюдаются в отношении лиц с полипозом носа, больных бронхиальной астмой или не переносящих аспирин. C. Bachert и соавт. обнаружили значительно более выраженную эозинофильную инфильтрацию в образцах тканей назальных полипов, содержащих высокую концентрацию иммуноглобулина (Ig) E [10]. Такая высокая концентрация IgE часто имеет место у больных, страдающих полипозом носа на фоне бронхиальной астмы или непереносимости аспирина. Другие исследователи подтверждают, что эозинофилия ткани при бронхиальной астме более выражена по сравнению с неастматиками [10-14]. Разница в притоке эозинофилов еще более отчетлива у астматиков, к тому же не переносящих аспирин [26, 28-30]. Это позволяет полагать, что у лиц, имеющих полипы больших размеров, которые склонны к многократному рецидивированию после операций, отмечается более агрессивный воспалительный ответ. Корреляция между выраженностью эозинофилии и тяжестью заболевания также свойственна бронхиальной астме: у пациентов с более высокими уровнями
эозинофилов наблюдаются более тяжелая симптоматика и более значительная остаточная обструкция дыхательных путей после использования бронходилататоров
[31-34].
Учитывая, что образование полипов обычно ограничено определенным участком слизистой оболочки, важно отметить, что в носовой полости эозинофилы распределяются по-разному. Как и следовало ожидать, в образцах тканей полипов активированных эозинофилов значительно больше по сравнению с контрольными («здоровыми») тканями из нижней и средней носовых раковин [16, 35, 36]. Отдельные авторы специально изучали вопрос распределения эозинофилов в полости носа у пациентов с назальными полипами. По их данным,
у одних и тех же больных в ткани полипов количество
эозинофилов значительно меньше, чем в нижней и средней носовых раковинах, а количество эозинофилов
в средней носовой раковине превышает их число
в нижней носовой раковине [16, 36, 37].
В завершение следует подчеркнуть, что мы по-прежнему не знаем, что инициирует первичное рекрутирование эозинофилов к месту образования назальных полипов. При аллергических ринитах эту роль может играть IL-5, вырабатывающийся
Th2-лимфоцитами. Для решения этого вопроса необходимо идентифицировать все клеточные источники IL-5.
Структурная перестройка слизистой оболочки носа: роль миофибробластов
Миофибробласты – это атипичные стромальные клетки, которые играют ключевую роль в патологических изменениях тканей как при полипозе носа, так и при бронхиальной астме. При изучении полипов с помощью электронной микроскопии обнаруживается ряд типичных изменений. Во-первых, участки поверхности полипа могут значительным образом отличаться друг от друга. Поверхность полипа частично покрыта нормальным (реснитчатым) респираторным эпителием, который прерывается участками эрозий, повреждений или сквамозной метаплазии эпителия. Характерна также гиперплазия бокаловидных клеток. Во-вторых, под этим частично поврежденным эпителием отмечается утолщение базальной мембраны (ретикулярной пластинки). В-третьих, строма полипов отличается массивным отеком, наличием псевдокист и субэпителиального фиброза с накоплением внеклеточного матрикса [38-43].
Интересно, что эти изменения очень сходны с таковыми слизистой оболочки околоносовых пазух при хроническом риносинусите [13, 27] и слизистой оболочки нижних дыхательных путей при бронхиальной астме
[44-49] у пациентов без полипоза. Эти же типичные признаки становятся еще более выраженными при наличии хронического риносинусита или полипоза носа на фоне бронхиальной астмы [13].
Патологические клетки, выявляющиеся под утолщенной базальной мембраной как при астме, так и при полипозе носа, отсутствуют в образцах «здоровой» слизистой оболочки бронхов и носовой полости [12, 50-53]. Эти клетки – миофибробласты, которые определяются как активированный фенотип фибробластов. Фибробласты, в норме находящиеся в тканях кожи, сердца, легких, носа, под влиянием трансформирующего фактора роста
(TGF)-β могут дифференцироваться до активных мио-фибробластов; это обычное явление при заживлении ран и дифференциации тканей [54-58].
Миофибробласты вырабатывают большое количество молекул внеклеточного матрикса, таких как коллаген
(I, III, IV и VIII типов) и фибронектин. Эта секреторная функция незаменима для репарации тканей и заживления ран. Цитоплазма миофибробласта содержит так называе-мые фибронексы, которые связывают натянутые нити
a-миофиламентов через трансмембранный белок ab-интегрин с фибронектином внеклеточного матрикса. За счет этого сокращение миофибробласта «подтягивает» окружающий внеклеточный матрикс, вследствие чего уменьшаются размеры поврежденного участка тканей. Процесс репарации ткани завершается апоптозом миофибробласта.
Миофибробласты играют важную роль при ряде заболеваний. Одно из них – бронхиальная астма, при которой взаимодействия между эпителием и миофибробластами лежат в основе патогенеза болезни. Предполагается, что подобные взаимодействия имеют решающее значение и в патогенезе полипоза носа.
Эпителий – активный участник воспаления и структурного ответа тканей
Традиционно назальный эпителий рассматривается как пассивный барьер, покрывающий полость носа, защищающий ткани от разнообразных патогенов и аллергенов. В то же время постепенно накапливаются данные о том, что эпителий – активный участник иммунологического ответа. При полипозе носа он одновременно является
и активным участником патогенеза, и пассивной мишенью патологических процессов. Эпителий играет центральную роль во взаимодействиях эозинофилов и миофибробластов.
Эпителий пассивно подвергается атаке эозинофилов, инфильтрирующих ткань. Активированные эозинофилы вырабатывают агрессивные кислородные радикалы и токсические белки (ECP и MBP), повреждающие респираторный эпителий [59, 60], а также способствуют резкому снижению частоты биения ресничек и нарушению целостности мембран эпителиоцитов [61-67]. Кроме того, в эпителии полипа пролиферация клеток значительно выше по сравнению с эпителием нижней носовой раковины у одних и тех же пациентов [68]. Это обусловлено тем, что повреждение эпителия, вызванное воспалительными медиаторами, активирует репаративные процессы эпителия и тем самым запускает пролиферацию.
Вместе с тем следует полагать, что эпителий сам частично ответствен за токсическую эозинофильную инвазию. В экспериментальной модели, где повреждение эпителия симулировалось неэнзиматической индукцией потери межклеточных контактов, была отмечена плейо-тропная индукция медиаторов. Это медиаторы, которые обычно вовлечены в процессы заживления и фиброза
(IL-1b, TGF-β, эпидермальный фактор роста [EGF], сосудистый эндотелиальный фактор роста [VEGF], инсулиноподобный фактор роста, или связывающий белок
[IGF-BP3], TIMP-1 и TIMP-2), а также медиаторы, участвующие в рекрутировании и активации клеток иммунной системы (IL-6, IL-8, колониестимулирующий фактор роста гранулоцитов [G-CSF], IL1-b,
γ-интерферон, фактор некроза опухоли-α, IL-4, IP-10, лейкемический ингибирующий фактор [LIF] и
GRO-α). В некоторых исследованиях показано, что эпителиальные клетки полипа вырабатывают ряд медиаторов, являющихся хемоаттрактантами для эозинофилов: GM-CSF, RANTES и эотаксин [15, 69-73].
Эпителиальные клетки не только привлекают эозинофилы к полипу, но и могут увеличивать длительность их жизни. При инкубации эозинофилов периферической крови, взятых от здоровых лиц, в питательной среде с культурой эпителиальных клеток назальных полипов
(human nasal polyp epithelium cell conditioned medium, HECM), выживание эозинофилов значительно возрастало вследствие угнетения апоптоза. Данный эффект можно было почти полностью блокировать, добавляя в HECM анти-GM-CSF [69, 70, 72]. Это указывает на то, что GM-CSF, продуцируемый эпителиальными клетками назальных полипов, – важнейший фактор, увеличивающий выживаемость эозинофилов.
Эпителий также играет активную роль во взаимодействиях с миофибробластами. В норме это взаимодействие необходимо для органогенеза. Так,
эпителиально-мио-фибробластное взаимодействие является ключевым для эмбриологического развития легкиих. При этом клетки секретируют растворимые медиаторы, ростовые факторы, интерстициальный матрикс и/или молекулы базальных мембран. Для пролиферации миофибробластов чрезвычайно важен тромбоцитарный фактор роста
(PDGF). H. Bostrom и соавт. установили, что постнатально у мышей, выживших с дефицитом PDGF-A, эмфизема легких развивалась вторично по отношению к поражению альвеолярных стенок. Это поражение было обусловлено потерей альвеолярных миофибробластов и сопровождалось накоплением эластичных волокон [74]. Принимая во внимание то, что
TGF-β необходим для дифференцировки миофибробластов, необходимо отметить, что этот фактор также индуцирует рецепторы к PDGF на миофибробластах. Среди других медиаторов, имеющих важное значение в активации и пролиферации миофибробластов, следует назвать
TGF-α, EGF, GM-CSF, FGF и IGF [75].
Миофибробласты часто обнаруживаются при бронхиальной астме: специфическое взаимодействие между эпителием и этими клетками считается частью патогенеза заболевания. Как упоминалось выше, бронхиальная астма (которая часто сопутствует назальному полипозу) имеет много общих гистопатологических черт с хроническим риносинуситом и полипозом носа. К ним относятся повреждение эпителия, утолщение ретикулярной пластинки, гиперплазия бокаловидных и гладкомышечных клеток, накопление внеклеточного матрикса и фиброз. Структурная перестройка слизистой оболочки бронхов у астматиков известна как «ремоделирование дыхательных путей» и ответственна за необратимость течения заболевания. Ключевая составляющая патологического процесса ремоделирования – взаимодействие между эпителиоцитами и миофибробластами, которое может проявляться в виде реактивации «мезенхимальной трофической единицы эпителия», играющей важную роль в нормальном развитии легкого [46, 49]. Как и для процесса нарушения заживления раны и формирования тканевого фиброза, неясно, что запускает возобновление работы этой системы, обязательной для нормального развития органа. Более высокая частота полипоза носа у астматиков – поразительное открытие, побуждающее нас предполагать сходство патогенеза обоих заболеваний.
Миофибробласты выявляются в таких патологических условиях, которые могут иметь определенное отношение к наличию этих клеток при полипозе носа. Прежде всего, если репарация ткани становится неконтролируемой, нарушается или повторяется, это обозначает, что миофибробласты не подвергаются апоптозу; может развиться фиброз [75]. При полипозе носа наивысшая плотность миофибробластов отмечается у ножки полипа. Этот участок, где, как предполагается, полип «растет», также отличается наивысшим содержанием
TGF-β-секретирующих (TGF-β+) клеток [51]. Высокий уровень
TGF-β обеспечивается секрецией инфильтрирующих ткань
эозинофилов и, вероятно, эпителиоцитов [76, 77]. Эпителий полипа может быть переведен в «репаративный фенотип» постоянным высвобождением пролиферативных и профибротических медиаторов. S. Zhang продемонстрировал это in vitro: он химическим путем повреждал культуру бронхиальных эпителиальных клеток с помощью поли-L-аргинина, который является суррогатом ECP. Поврежденные эпителиальные клетки при этом значительно увеличивали дифференциацию миофибробластов за счет высвобождения большого количества
TGF-β, bFGF, IGF-1 и PDGF [78]. Подобную индукцию пролиферации миофибробластов, наряду с активацией синтеза коллагена I и III типа миофибробластами, наблюдали Y. Morishima и соавт. после механического повреждения культуры бронхиальных эпителиальных клеток морской свинки [79]. В этом случае фиброз выступает главной конечной точкой патологического процесса активации и пролиферации миофибробластов. Действительно, миофибробласты определяются как ведущие факторы в заболеваниях фибротического
характера, таких как фиброз поджелудочной железы, фиброз и цирроз печени, склерозирующий гломеруло-нефрит, фиброз при болезни Крона, фиброз легкого и др. Вместе с тем при полипозе фибротические изменения не доминируют: фиброз очевиден только в области ножки полипа, где локализуется основная часть миофибробластов. Большая часть стромы полипа остается отечной. Однако наличие миофибробластов в назальных полипах указывает на патологический репаративный ответ на повреждение, при котором нарушается нормальный апоптоз клеток. Но что именно нарушает нормальный репаративный процесс? Что запускает этот «активный» фенотип эпителия и угнетает апоптоз миофибробластов и
эозинофилов?
Выбор терапии
Причина, вынуждающая искать новые мишени для терапевтических воздействий при назальном полипозе носа, достаточно ясна: до настоящего времени все еще нет методов, позволяющих излечить пациента от этого заболевания. В данном разделе будут представлены существующие методы лечения полипоза носа. Особое внимание уделено золотому стандарту терапии полипоза – стероидам, а также противомикробной терапии. В завершение мы представим изучаемый в последнее время метод воздействия на медиаторы, чтобы объяснить, как фундаментальные исследования могут приводить к появлению новых потенциальных мишеней для лечения.
Лечение стероидами
На основании данных обзора литературы, посвященного методам лечения полипоза носа, Европейское соглашение о ведении риносинуситов и назальных полипов предлагает стратегию терапии этого заболевания в соответствии с принципами доказательной медицины [2]. Стероиды являются краеугольным камнем в лечении полипоза носа. Их использование может варьировать от спреев (аэрозолей), содержащих топические стероиды, применяемых при небольшом или умеренном полипозе, до короткого курса системных стероидов у пациентов с тяжелым течением болезни. Существует довольно много доказательных данных об эффективности как топических, так и системных стероидов для уменьшения размеров полипов и симптомов, свойственных полипозу носа [80-84]. Однако значительное число больных оказываются рефрактерными к терапии стероидами или же отличаются постепенным снижением чувствительности к препаратам этого ряда. Почему одни пациенты отвечают на это лечение, а другие нет? Один из важных вопросов, имеющих отношение к данной проблеме, – достигает ли стероид полипа при местном применении? При прямом сравнении стероидов, использующихся в спреях и каплях, 50% больных, не отвечавших на применение назального спрея, успешно лечились каплями [85]. Весьма вероятно и то, что введение жидких форм при наклонном положении головы позволяет стероиду лучше достигать полипа, чем обычный спрей. Вместе с тем не все случаи неэффективности стероидов обусловлены неправильным применением лекарства, что подтверждается наличием рефрактерности к системным стероидам. C. van Camp и P.A. Clement показали, что терапия полипоза носа системными стероидами была успешна лишь
у 72% пациентов [86]. Это означает, что примерно у одного из трех больных с полипозом носа такая терапия нерезультативна и необходимо оперативное удаление полипов. Данные некоторых исследований, посвященных бронхиальной астме, позволяют полагать, что за неудачу лечения стероидами может быть ответственным соотношение между двумя видами рецепторов к глюкокортикоидам
(GR). Глюкокортикоидрезистентная бронхиальная астма ассоциирована со значительно большим количеством
GR-β+ воспалительных клеток [87, 88]. Хотя это направление еще недостаточно изучено, вышеуказанное справедливо и в отношении глюкокортикоидрезистентного полипоза носа [89]. Однако пока неизвестно, являются ли пациенты с назальным полипозом и сопутствующей глюкокортикоидрезистентной бронхиальной астмой резистентными к стероидам в отношении полипов.
Противомикробная терапия
При изучении ряда микроорганизмов была выявлена их ключевая роль в патогенезе хронического риносинусита и полипоза носа. J.U. Ponikau и соавт. показали, что у 96% из 210 больных, страдающих хроническим риносинуситом, в носовой слизи определяются грибы [90].
H. Braun и соавт. обнаружили схожую высокую частоту грибковой колонизации у пациентов с хроническим риносинуситом (91%), в то же время A. Ragab и соавт. установили, что грибковая колонизация столь же часто встречается и у здоровых лиц (91-100%) [91, 92]. Несмотря на то что в двух неконтролируемых исследованиях [93, 94] была продемонстрирована эффективность противогрибковой терапии, а в другом, плацебо-контролируемом, – небольшая редукция объема тканей полипа на фоне подобной терапии по данным компьютерной томографии [95], позже были получены результаты многоцентровых испытаний, не подтвердившие эти данные. В двух двойных слепых плацебо-контролируемых рандомизированных исследованиях изучали эффективность топической противогрибковой терапии при полипозе носа на фоне хронического риносинусита [96, 97]. В одном из них использовался противогрибковый спрей [96], в другом – назальный лаваж раствором противогрибкового препарта [97] на протяжении 2-3 месяцев; в обоих исследованиях отмечена неэффективность данной тактики в уменьшении симптоматики и улучшении эндоскопической картины полости носа. Кроме того, 6-месячный курс тербинафина перорально у пациентов с хроническим риносинуситом и без назального полипоза также не привел к каким-либо улучшениям в клинической симптоматике и по данным компьютерной томографии [98].
Другими часто встречающимися в слизи назальных полипов патогенами являются бактерии, главным образом золотистый стафилококк [99-101]. T. van Zele и соавт. показали, что колонизация
S. aureus в среднем носовом ходе у пациентов с полипозом носа выше (64%), чем у больных хроническим риносинуситом (27%) и у здоровых лиц (33%) [99]. Уровень колонизации
S. aureus пропорционален содержанию специфических IgE – антител к энтеро-токсинам золотистого стафилококка (SAEs). Концентрация специфических IgE к SAEs в тканях выше у пациентов с полипозом носа и сопутствующими бронхиальной астмой и непереносимостью аспирина. У этих больных обнаруживаются достаточно высокие уровни эозинофильной инфильтрации назальных полипов и продукции IgE. Выработка IgE при этом мультиклональна, что указывает на то, что SAEs действуют как суперантигены, активирующие большое число субпопуляций Т-лимфоцитов [10]. Золотистый стафилококк также является преобладающей бактерией у пациентов с атопическим дерматитом [102],
у которых эрадикация S. aureus способствует значительному (хотя и временному) улучшению симптоматики [103]. Потенциальный терапевтический эффект эрадикации
S. aureus при полипозе носа пока не изучен, однако уже проводятся крупномасштабные двойные слепые плацебо-контролируемые исследования, посвященные этому вопросу.
В прошлом некоторые исследователи изучали возможную роль вирусов в патогенезе полипоза носа. Однако оказалось, что вирусы обнаруживаются как у здоровых лиц, так и при полипозе носа. Поэтому нет смысла изучать возможности противовирусной терапии при этом заболевании.
Лечение путем воздействия на медиаторы (анти-IL-5)
При полипозе носа эозинофилы являются основными инфильтрирующими воспалительными клетками. Логичной терапевтической целью представляется попытка остановить эту токсическую инвазию. При бронхиальной астме такая попытка осуществлялась с помощью внутривенного введения анти-IL-5 моноклональных антител. Эта стратегия обусловила уменьшение количества циркулирующих в крови эозинофилов у 100% пациентов
и эозинофилов в тканях дыхательных путей – примерно у 50% [104, 105]. Кроме того, было отмечено значительное уменьшение числа
TGF-β+ эозинофилов в дыхательных путях и концентрации
TGF-β в жидкости, полученной при бронхоальвеолярном лаваже [106]. Вместе с тем лечение анти-IL-5 не способствовало улучшению клинической симптоматики астмы. В результате был сделан вывод о том, что анти-IL-5 может уменьшать количество эозинофилов в дыхательных путях, но не останавливать их инвазию. Это позволяет предположить, что IL-5 – не единственный и не самый важный фактор, ответственный за инфильтрацию тканей эозинофилами и их выживание в слизистой оболочке бронхов при астме.
P. Gevaert и соавт. изучали эффективность внутривенного введения анти-IL-5 моноклональных антител при полипозе носа [107]. В двойном слепом плацебо-контролируемом рандомизированном исследовании до и после лечения сопоставлялись размеры полипов по данным назальной эндоскопии, а также клиническая симптоматика и оценка пиковой объемной скорости выдоха через нос по сравнению с контрольной группой. Так же как и в исследовании с бронхиальной астмой, авторы отмечали нормализацию уровня эозинофилов в крови, но лишь частичное снижение эозинофильной инфильтрации тканей.
При анализе подгрупп были получены некоторые интересные данные. В зависимости от улучшения по данным эндоскопии в течение 4 недель от начала исследования пациенты были разделены на группу тех, кто отвечает на лечение анти-IL-5, и группу тех, кто не отвечает на него. В подгруппе ответивших на лечение имели место значительно более высокие уровни IL-5 в лаваже носовой полости, чем в группе сравнения. Ранее D.L. Hamilos и соавт. продемонстрировали, что IL-5 – не единственная молекула, ответственная за рекрутирование эозинофилов. Судя по всему, при отсутствии аллергии эозинофилы рекрутируются в назальные полипы преимущественно вследствие высвобождения GM-CSF, чем посредством IL-5 [15]. Эти наблюдения позволяют полагать, что терапевтический эффект анти-IL-5 может иметь место только у больных с атопией и высокими уровнями IL-5. В таком случае лечение было бы эквивалентно редукции «аллергической» эозинофильной инфильтрации. К сожалению, атопический статус для пациентов, принимавших участие в исследованиях с анти-IL-5, не был описан.
Заключительные замечания
Несмотря на достаточно большое количество экспериментальных исследований, простейшие процессы, обусловливающие образование полипов, все еще остаются неясными и перед нами стоит множество вопросов, на которые пока не получены ответы. Если полипоз носа столь часто встречается при хроническом риносинусите, является ли он проявлением хронического риносинусита или же это два самостоятельных заболевания? Учитывая, что полипы, как оказалось, происходят из достаточно небольшого участка слизистой оболочки, следует ли рассматривать полипоз носа как локальное заболевание или же полипы являются местным проявлением системной патологии? Каким образом сопутствующие заболевания воздействуют на назальные полипы?
Очевидным представляется то, что не существует какого-то единого механизма, ответственного за развитие полипоза носа. В патогенезе этой патологии значимо комплексное взаимодействие различных звеньев, включая клетки-резиденты ткани (эпителий), воспалительные (например, эозинофилы) и патогенные клетки (мио-
фибробласты). Но патогенез полипоза носа не ограничивается взаимодействием между этими факторами. Токсические продукты эозинофилов могут повреждать эпителий, в то время как факторы, вырабатываемые эпителием, привлекают и удерживают эозинофилы. Подобные взаимодействия можно наблюдать также между эпителием и миофибробластами, они определяют каскад патологических процессов, их порочный круг, что обусловливает прогрессирование заболевания. Лучшее понимание этих комплексных взаимодействий может помочь нам прервать этот порочный круг и разработать новые методы терапии.
Если основываться на нашем понимании роли эозинофилов в патогенезе полипоза носа (аллергической формы) и способах контроля их дифференциации и активации с помощью анти-IL-5, можно предполагать, что использование анти-IL-5 для лечения заболевания будет результативным. К сожалению, этот подход оказался успешным лишь частично. Анализ подгрупп позволяет судить о том, что на такую терапию отвечают только больные с высоким уровнем IL-5. Полипоз носа – гетерогенное и очень сложное заболевание, для которого IL-5 не является единственной молекулой, ответственной за звенья патогенеза, связанные с эозинофилами. Как было показано в этом обзоре, IL-5 может не играть существенной роли при неаллергической форме полипоза носа. Исследователи часто сосредотачивают свое внимание на ограниченном числе молекул, поскольку в нашем распоряжении очень мало методик, позволяющих проводить всесторонний анализ для множества разных факторов. Сегодня с помощью твердофазного иммуноферментного анализа (Enzyme-Linked ImmunoSorbent Assay, ELISA) можно исследовать до 30 различных белковых медиаторов одновременно, и хотя наши возможности все еще ограничены, все же мы уже можем получать более
полную картину. Подобные преимущества могут быть достигнуты и при использовании метода ДНК-микрочипов, позволяющего определять профили экспрессии
55 тыс. генов одновременно.
Ввиду множества параллелей между ремоделированием тканей при бронхиальной астме и полипозе носа, необходимо больше внимания уделять взаимодействию эпителия полипов и (мио)фибробластов. Этим взаимодействием могут объясняться особенности повреждения и пролиферации эпителия, рекрутирования и выживания воспалительных клеток, дифференциации миофибробластов, накопления внеклеточного матрикса и т.д. Подходы, связанные с протеомикой и геномикой, представляются наиболее приемлемыми для идентифицирования различных «игроков», вовлеченных в этот порочный круг, который лежит в основе патогенеза полипоза носа.
До недавних пор метод ДНК-микрочипов редко использовался в изучении полипоза носа. S.B. Fritz и соавт. исследовали различия в экспрессии генов между слизистой оболочкой полости носа у больных аллергическими ринитами с полипозом носа и без такового [108]. При этом было обнаружено 34 гена, экспрессировавшихся по-разному для двух групп пациентов. Некоторые из этих генов кодировали воспалительные медиаторы, хотя белки, синтезирующиеся на основе генов с наибольшими отличиями экспрессии между группами, были описаны в ассоциации с разными формами неоплазии (например, маммаглобин). Подобные результаты получены Z. Liu и соавт., которые сравнивали профили экспрессии генов между образцами тканей назальных полипов и нормальной слизистой оболочки решетчатого синуса [109]. Ими также обнаружены различия в экспрессии нескольких генов, ассоциированных с медиаторами воспаления, и генов, имеющих возможное отношение к ингибированию апоптоза. К сожалению, в этом исследовании пациенты с полипозом носа представляли собой гетерогенную группу – некоторые из них имели сопутствующие проблемы (бронхиальную астму, аллергическую патологию или непереносимость аспирина). К тому же образцы тканей, использованные для анализа, включали множество типов клеток, каждый со своим профилем экспрессии. Из-за значительных различий между разными образцами тканей сложно сделать уверенные выводы на основе полученных данных.
В будущих исследованиях предстоит выяснить ряд вопросов: какие факторы, вырабатывающиеся эпителиоцитами, могут иметь отношение к патогенезу полипоза носа и хронического риносинусита? является ли назаль-ный полипоз локальным или системным заболеванием? является ли полипоз носа просто заболеванием, которое модифицируется коморбидной патологией, или же назальные полипы – обычная находка при разнообразных патологиях?
*Department of Otorhinolaryngology, Head and Neck Surgery, Academic Medical Centre, Amsterdam, The Netherlands.
**Department of Otorhinolaryngology, Kymenlaakso Central Hospital, Kotka, Finland.
Список литературы находится в редакции
Реферативный обзор статьи A.B. Rinia et al. «Nasal polyposis: a cellular-based approach to answering questions» (Allergy 2007; 62 (4): 348-358) подготовлен редакцией журнала
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Стафилококк. Вооружен, опасен, но победим
Стафилококк. Вооружен, опасен, но победим
 С приходом осени о ринитах и риносинуситах
С приходом осени о ринитах и риносинуситах
 Какие исследования нужны во время беременности и зачем?
Какие исследования нужны во время беременности и зачем?
 Воспалительные заболевания околоносовых пазух
Воспалительные заболевания околоносовых пазух