- Головна
- /
- Статті
- /
- Отоларингологія
- /
- Ежегодная традиционная осенняя конференция Украинского научного медицинского общества оториноларингологов
Ежегодная традиционная осенняя конференция Украинского научного медицинского общества оториноларингологов
С 19 по 21 сентября в Харькове состоялась ежегодная традиционная осенняя конференция Украинского научного медицинского общества оториноларингологов. В ходе конференции были проведены заседания на темы: «Острые и хронические риниты», «Воспалительные
С 19 по 21 сентября в Харькове состоялась ежегодная традиционная осенняя конференция Украинского научного медицинского общества оториноларингологов. В ходе конференции были проведены заседания на темы: «Острые и хронические риниты», «Воспалительные заболевания глотки», «Криотерапия и криохирургия в оториноларингологии», «Воспалительные заболевания уха. Отоневрология», «ЛОР-онкология».
В данной публикации приведены некоторые доклады, прозвучавшие на первых двух научных заседаниях.
Острые и хронические риниты
Хронический катаральный ринит (ХКР) – одно из наиболее распространенных заболеваний в ринологии, которое плохо поддается лечению. Актуальной задачей его является создание адекватной по патологическим проявлениям лабораторной модели, что способствовало бы увеличению эффективности скрининга новых способов лечения этого недуга. В докладе
«Модель хронического катарального ринита» (Д.И. Заболотный, О.Ф. Мельников, г. Киев) было отмечено, что развитие хронического воспаления в слизистой оболочке носовой полости на начальной стадии может быть обусловлено иммунологическими механизмами, в частности накоплением в собственном слое слизистой оболочки провоспалительного IgG. Пролонгация воспалительного процесса способствует как количественному уменьшению, так и угнетению функциональной активности иммунокомпетентных клеток, усилению продукции IgE аутоантител, ослаблению фагоцитарной активности полиморфноядерных лейкоцитов, появлению эозинофилии при поддержке экспериментального ринита декстраном. Оптимальная модель ХКР у крыс – воспаление слизистой оболочки носа, индуцированное двумя интраназальными закапываниями 0,1% раствора декстрана на фоне иммуносупрессии, обусловленной введением циклофосфана и пролонгации ее путем дополнительных инстилляций 0,1% раствора декстрана 1 раз в месяц на протяжении 2-3 месяцев.
В последние годы, наряду с парентеральными методами специфической иммунотерапии (СИТ), с успехом используются неинвазивные методы введения аллерговакцин (сублингвальный, пероральный, интраназальный). В докладе
«Опыт применения пероральной специфической иммунотерапии у больных с аллергическим ринитом» (А.Г. Балабанцев, Т.А. Крылова и др., г. Симферополь) подчеркивалось, что относительно высокая эффективность пероральной СИТ обусловлена двумя точками контакта аллергена с иммунокомпетентными клетками: в области лимфоглоточного кольца и в пейеровых бляшках кишечника, куда часть аллергена попадает с заглатываемой слюной. К преимуществам СИТ методом применения драже с аллергенами следует отнести высокую эффективность (свыше 80% отличных и хороших результатов), меньшую частоту побочных реакций, отсутствие необходимости в контроле со стороны медработников, удобство для пациентов, лучшие возможности комбинированной фармакотерапии, более высокую экономичность (Д.И. Заболотный и соавт., 2004).
Как отмечалось в докладах, прозвучавших на конференции, в последние годы значительно возрос интерес к патологии клиновидной пазухи. Термин «забытая пазуха» стал уже историческим аспектом в мировой ринологии, что объясняется накопленным за последние десятилетия клиническим опытом и возможностями современного диагностического и хирургического оборудования. Рост частоты вмешательства на клиновидной пазухе как по поводу патологических изменений, так и при вмешательствах на смежных анатомических структурах, приводит к появлению более рациональных хирургических методик.
Днепропетровские специалисты (В.В. Березнюк, Е.В. Сапронова и др.) в докладе «Особенности эндоназальных доступов к клиновидной пазухе» акцентировали внимание на том, что сегодня при вмешательствах на клиновидной пазухе применяют: трансназальный доступ, который обоснован в случаях изолированных сфеноидов и ликвореи с источником в клиновидной пазухе; трансэтмоидальный – при сочетанном поражении клиновидной пазухи и клеток решетчатого лабиринта; транссептальный доступ к клиновидной пазухе при ликвореи, а также при гипофизэктомии. Докладчики представили результаты применения модифицированного транссептального доступа в случаях трансфеноидального удаления опухолей гипофиза. Модифицированный доступ позволяет уменьшить травматизацию тканей во время оперативного вмешательства, оптимизировать процессы заживления в послеоперационном периоде.
В докладе «Эндоскопические методики в лечении верхнечелюстных синуситов» (С.Б. Безшапочный, В.В. Лобурец, г. Полтава) отмечалось, что во многих случаях постановка точного диагноза верхнечелюстного синусита возможна только при условии визуализации очага заболевания, что достигается путем гайморотомии. Оперативные доступы и объемы вмешательства могут быть различными, что в значительной мере зависит от причин и особенностей течения синусита. С внедрением в ринологию эндоскопических технологий оперативные вмешательства изменились, сегодня гайморотомию проводят с минимальной травматизацией анатомических структур, сохраняя природные функциональные возможности носовых пазух.
Обязательное условие для определения объема вмешательства и эффективного его проведения – предоперационное обследование, которое включает оптическую эндоскопию полости носа и носоглотки и рентгенографию околоносовых пазух, компьютерную рентгенологическую или магнитно-резонансную томографию. В отдельных случаях применяют контрастную рентгенографию верхнечелюстных пазух. При нарушении функций дренажного отверстия проводят диагностическую пункцию пазухи, при необходимости исследования оперированной пазухи – эндоскопию с использованием искусственного отверстия.
Кроме того, необходимо обращать внимание на этиологию заболевания, характер его течения, вид микрофлоры, наличие морфологических нарушений в полости носа. При риногенном верхнечелюстном синусите, особенно при морфологических нарушениях, которые требуют дополнительной коррекции, проводят преимущественно эндоназальную функциональную гайморотомию. Это обусловлено необходимостью в большинстве случаев проведения этмоидотомии с удалением преград для нормального дренажа как со стороны остиомеатального комплекса, так и верхнечелюстной пазухи. При одонтогенном непродолжительном воспалении верхнечелюстной пазухи с сохранением дренажной функции выполнить вмешательство можно, применив экстраназальную гайморотомию – щадящую синусоскопию.
Широкое внедрение эндоскопических методов лечения синуситов в повседневную практику оториноларингологов Украины затруднено из-за высокой стоимости оборудования (100-150 тыс. грн.). Целесообразность затрат на приобретение эндоскопической техники для реализации государственных программ, а также результаты поисков коммерческих партнеров администрациями больниц и ЛОР-клиник представлены в докладе
«Экономический эффект эндоскопического метода «причинного» лечения синуситов» (С.К. Боенко, А.А. Попов и др., г. Донецк). В ринологическом центре Донецка с 1999 по 2003 гг. наблюдались 2059 больных синуситами, 609 пациентов трудоспособного возраста прооперированы с помощью эндоскопического метода. Экономический эффект метода складывается из устранения или уменьшения социальных затрат (оплата больничных листов, сокращение сроков пребывания в стационаре и др.) и производственных потерь в связи с временной потерей трудоспособности.
Ближайший экономический эффект эндоскопического хирургического лечения составил 299,74 грн., отдаленный эффект – 9 204,8 грн., от устранения осложнений синуситов и инвалидизации – 299,04 грн., или 1 839 у.е., предполагаемый экономические потери из-за болезни работника – 196 060 грн., или 36 784 у.е.
Таким образом, социальный экономический эффект эндоскопического метода лечения синуситов одного больного составляет 9 803,58 грн., или 1 839 у.е., суммарный экономический эффект современного хирургического лечения одного больного – 205 863 грн., или 38 623 у.е.
Совокупность бактерий, вирусов, грибов и простейших, в норме заселяющих полости и покровы организма, называется микробиотой. В докладе
«Микробиота и ее роль при ринитах» (Г.Д. Тарасова, Е.В. Василенко, г. Москва) отмечено, что в течение тридцати лет продолжается дискуссия о взаимодействии аллергии и инфекции. Считается, что у больных с атопией именно персистирующая инфекция провоцирует формирование порочного круга, который становится базой для развития хронических аллергических заболеваний. В ряде исследований доказана способность индукции IgE к бактериальным агентам у больных с аллергическим анамнезом. Доказано также, что при повышенном заселении стафилококком слизистой оболочки верхних дыхательных путей развивается усиленный «супериммунный» ответ на возбудитель, проявляющийся в виде аллергии. Таким образом, от состояния микроэкологической среды могут зависеть результат и прогноз хронических заболеваний верхних дыхательных путей.
Были представлены результаты исследований (с участием 103 пациентов) состояния микрофлоры, колонизирующей слизистую оболочку носа при персистирующих аллергических и хронических инфекционных ринитах. Авторами была разработана и предложена следующая схема терапии. На первом этапе лечения – деконтоминация с помощью антибактериальных препаратов широкого спектра действия в зависимости от чувствительности микрофлоры, на втором – восстановление микробиоты с помощью пробиотиков. Одновременно рекомендуется применение пребиотиков, которые улучшают приживаемость нормальной флоры. Третий этап – иммунокоррегирующая терапия, выбор которой индивидуален и зависит от существующих нарушений иммунитета.
По данным исследования, в результате проведенного лечения состояние у 66,9% больных значительно улучшилось, что проявлялось в виде облегчения носового дыхания, отказе от декогестантов. У 21% больных результаты лечения были удовлетворительными. Необходимость исследования состояния микробиоты, а именно выяснение причин ее дисбиоза как при хронических инфекционных заболеваниях полости носа, так и при персистирующих аллергических ринитах, а также при осложнениях в виде одновременного течения хронического инфекционного ринита и хронических синусита, аденоидита, позволяет подобрать адекватную тактику ведения больного.
Воспалительные заболевания глотки
Лечение хронического тонзиллита у детей – сложная и во многом нерешенная проблема, которая включает консервативные и хирургические методы. В докладе
«Опыт лечения детей с хроническим тонзиллитом с применением внутритканевого ультрафонофореза лекарственных веществ» (А.Л. Косаковский и др., г. Киев) отмечено, что при этом заболевании даже оперативное вмешательство не всегда дает положительные результаты, а некоторым больным вообще противопоказано. Удаление небных миндалин нарушает структурно-функциональные взаимоотношения и нередко приводит к иммунной недостаточности слизистой оболочки глотки и организма в целом (С.В. Филатов и др.., 2002; Kinciogullari et al., 2002; Marshall, 2002). При хроническом тонзиллите, особенно у детей, необходим взвешенный подход к хирургическому вмешательству, поэтому разработка методов консервативного лечения данной патологии достаточно актуальна.
В докладе были представлены результаты изучения эффективности внутритканевого ультрафонофореза лекарственными веществами. Детей разделили на две группы, идентичные по возрасту и характеру заболевания. Все пациенты получали традиционную терапию, которая включала промывание лакун небных миндалин раствором антисептика или антибиотика с учетом чувствительности микрофлоры, а также десенсибилизирующую терапию, физиотерапию и средства, направленные на повышение реактивности организма. Особенность лечения больных основной группы состояла в том, что им дополнительно вводили 1/2 разовой дозы антибиотика (полусинтетический пенициллин или цефалоспорин), подобранного с учетом чувствительности микрофлоры лакун небных миндалин, вместе с 1/4 суточной дозы иммуномодулятора (полиоксидония) с последействием на проекцию небных миндалин через кожу ультразвуком частотой 880 кГц в беспрерывном режиме интенсивностью 0,2-0,4 Вт/см2 продолжительностью 10 минут ежедневно на протяжении 10 дней. Пациентам контрольной группы проводили ультрафонофорез с гиоксизованной мазью на проекцию миндалин по традиционной методике с использованием ультразвука тех же параметров.
У детей основной группы после 3-5 процедур улучшилось общее состояние, нормализовалась температура у некоторых пациентов с субфебрилитетом, уменьшились проявления воспалительного процесса в небных миндалинах. У детей контрольной группы такая динамика была отмечена лишь после полного курса лечения. В отдаленном периоде на протяжении года количество ангин у больных основной группы снизилось в 1,9 раза, число паратонзиллярных абсцессов – в 2,3 раза. Кроме того, дети основной группы значительно реже болели ОРВИ.
В докладе Г.И. Гарюка и Ю.В. Тимошенко (г. Харьков), посвященном диагностическим критериям развития паратонзиллярного абсцесса подчеркивалось, что в патогенезе данного осложнения существенную роль играет начальная его стадия. К такому выводу авторы пришли в результате более тщательного изучения стадий развития паратонзиллярного абсцесса. Ими разработан неинвазивный метод контроля за данным процессом на основе ультразвукового исследования и анализа раннего периода формирования паратонзиллярного абсцесса.
Результаты обследования 42 больных на разных этапах развития паратонзиллярного абсцесса позволили сделать ряд выводов. При ультразвуковом анализе обнаружены увеличенные миндалины со значительной бугристостью на фоне содержания в сыворотке крови сиаловых кислот не более 300 единиц, хондроитинсульфатов – не более 200 г/л, пробы Вельтмана – не ниже 4, среднемолекулярных пептидов – до 300 усл. ед., что соответствует стадии отека при осложнении паратонзиллита и позволяет исключить диагностическую пункцию или разрез, чтобы не допустить дальнейшего распространения инфекционного начала в окружающие ткани. Стадия формирования абсцесса и сформировавшийся паратонзиллярный абсцесс, отличающиеся при ультразвуковом исследовании, кроме увеличения и выраженной бугристости миндалин, наличия зон с нетипичными эхогенными, гипер- или анэхогенными характеристиками и псевдокапсул, в сравнении со здоровой тканью миндалин, имеет специфические биохимические характеристики: содержание сиаловых кислот выше 300 единиц, гаптоглобина – более 2 г/л, среднемолекулярных пептидов – 400-600 усл. ед.; показатель Вельтмана выше 4 проб, что подтверждает необходимость оперативного вмешательства.
В докладе «Лечение ингаляционных поражений у обоженных с применением современных антибактериальных и противовоспалительных препаратов» (Е.Н. Трофимова и др., г. Донецк) отмечалось, что ингаляционные поражения (ИП) у обоженных происходят в результате трех основных этиопатогенетических процессов: термической травмы дыхательных путей, воздействия токсических компонентов дыма и газов-асфиктантов, токсининдуцированного неспецифического воспаления дыхательных путей (С.К. Боенко и соавт., 1990; J.S. Guy, M.D. Peck, 1999). В механизме развития неспецифического воспаления большую роль играет образование в поврежденных тканях медиаторов воспаления, таких как эйкозаноиды и цитокины, кислородных радикалов и протеолитических ферментов, что усугубляет поражение тканей (K.A. Lafferty, 2001). Повышенная чувствительность токсически поврежденных дыхательных путей к инфекции служит инициирующим фактором для развития бактериальных и грибковых осложнений, сепсиса (А.А. Алексеев и соавт., 1997; R. Sheridan, 1998; K.A. Lafferty, 2001). По данным отдела термических поражений и пластической хирургии Института неотложной и восстановительной хирургии, АМН Украины ИП возникают у 15-23% госпитализированных, а ассоциированная с ИП летальность достигает 26-37% (по данным 1999-2003 гг.).
Согласно современным взглядам, патогенез ИП предполагает применение комплексной терапии лекарственными средствами, изменяющими выделение медиаторов. Глюкокортикоиды подавляют синтез медиаторов воспаления (ПГ, ЛТ, ИЛ-1, ИЛ-2, ТАФ, гистамина и др.) посредством ограничения доступности арахидоновой кислоты (Р.Дж. Флауэр, М.М. Дейл, 1998). Докладчик привел результаты лечения 385 пострадавших с сочетанными или изолированными ИП, которые получали глюкокортикоиды парентерально (гидрокортизон – 300-1000 мг в сутки, преднизолон – 90-300 мг в сутки, дексаметазон – 8-32 мг в сутки) и в виде ингаляций. Профилактику бактериальных осложнений со стороны дыхательных путей осуществляли парентеральным назначением антибиотиков широкого спектра действия и современного ингаляционного антибактериального и противовоспалительного препарата (фузафунжина). При выборе последнего необходимо обращать внимание на стабильность антибактериального спектра в отношении большинства возбудителей инфекций верхних дыхательных путей и грибков рода Candida, чтобы предупредить возникновение кандидоза при длительном применении антибиотиков.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Опыт клинического применения перорального цефалоспорина ІІІ поколения Цеподема в лечении острых и хронических форм пиодермии
Опыт клинического применения перорального цефалоспорина ІІІ поколения Цеподема в лечении острых и хронических форм пиодермии
 Боль в горле – обратите внимание!
Боль в горле – обратите внимание!
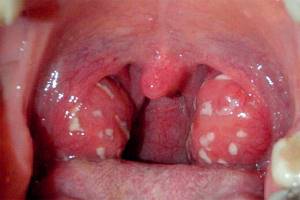 Хронический тонзиллит
Хронический тонзиллит
 Тонзилгон® Н — современный профиль фитотерапии
Тонзилгон® Н — современный профиль фитотерапии