- Головна
- /
- Статті
- /
- Кардіологія
- /
- Фібриляція шлуночків, асистолія та електромеханічна дисоціація: стандарти діагностики, реанімації та профілактики згідно з доказовою медициною
Фібриляція шлуночків, асистолія та електромеханічна дисоціація: стандарти діагностики, реанімації та профілактики згідно з доказовою медициною
Велике значення має вивчення раптової серцевої смерті (РСС), яка є частою причиною при різних захворюваннях системи кровообігу. РСС або первинна зупинка серця – це смерть у присутності свідків, яка настає при ішемічній хворобі серця (ІХС) раптово впродовж однієї години з моменту появи ознак захворювання, або у осіб, які до цього були абсолютно здоровими, чи у хворих, стан яких був задовільним.
До РСС не відносять смерть у результаті інфаркту міокарда (ІМ) через 1 годину після його виникнення, а також від шоку та набряку легень, оскільки причиною смерті є не захворювання, а відмічені ускладнення.
РСС значно «помолодшала» і може зустрічатись у осіб віком 20-30 років. У 80-90% випадків РСС виникає на догоспітальному етапі до приїзду швидкої допомоги.
Етіологія. Причинами РСС у 80-90% випадків є ІХС (ІМ, різні форми стенокардії, постінфарктний кардіосклероз, аритмії та блокади серця), кардіоміопатії, гіпертонічна хвороба, набуті та вроджені вади серця, аномалії, провідна система серця (синдром Вольфа-Паркінсона-Уайта, Кларка-Леві-Крітеско), пролапс мітрального клапана, тампонада серця, хронічна серцева недостатність (ХСН) тощо. Вона може виникати також при захворюваннях органів дихання (бронхіальна астма, хронічні обструктивні захворювання легень, тромбоемболія легеневої артерії), органів травлення (загальні отруєння, перитоніти, гепатити, цирози печінки, кровотечі), при застосуванні симпатоміметиків (норадреналін, адреналін, допамін, мезатон), бронхолітиків (сальбутамол, беротек тощо), антиаритмічних препаратів (ААП) – хінідин, дизопірамід, флекаїнід, аміодарон, верапаміл тощо [3-5, 8].
Патогенез. Вважають, що основною причиною РСС є аритмії, блокади серця та розвиток електричної нестабільності міокарда.
До пускових факторів РСС відносяться:
- гостра ішемія міокарда, зумовлена коронароспазмом, тромбозом, у тому числі реперфузією, підвищенням потреби міокарда в кисні;
- дисбаланс вегетативного статусу з перевагою симпатичного;
- порушення метаболізму міокарда (гіпокаліємія, гіпомагніємія);
- токсичні фактори, в тому числі застосування симпатоміметиків, бронхолітиків, ААП, що підвищують збудливість міокарда чи подовжують інтервал Q-T (проаритмічні реакції);
- блокада натрієвих каналів новокаїнамідом та етацизином збільшує ступінь гіпополяризації мембран кардіоміоцитів, у результаті чого при введенні мінімальних аритмогенних доз хлориду калію виникають гіпополяризаційні порушення ритму серця (екстрасистолія, блокади серця, короткі епізоди тріпотіння та фібриляції шлуночків – ФШ) [10].
Причиною РСС при захворюваннях серця та судин є ФШ (85%), асистолія (20%) та електромеханічна дисоціація (5%), причому відсоток пацієнтів, які вижили і перенесли хоч один епізод фатальних аритмій, невеликий і становить 19% від загальної кількості.
Прогноз. Є різні критерії прогнозування РСС (специфічних критеріїв немає), які ми систематизували в алгоритмі 1.
Алгоритм 1. Прогнозування раптової серцевої смерті у хворих на ІХС [2, 3]
- Тяжкі ураження міокарда, що супроводжуються ішемією (часті напади стенокардії, депресія сегменту ST у спокої та при фізичному навантаженні)
- Перенесений ІМ і наявність зубця Q на ЕКГ
- В анамнезі успішна реанімація після ФШ та асистолії
- ХСН ІІБ – ІІІ ступеня (класифікація NYHA 3-4 ФК)
- Дисфункція міокарда та зниження фракції викиду (ФВ) менше 40% збільшує ризик РСС в 4 рази
- Виражена кардіомегалія та збільшення розмірів порожнин серця (за даними ЕхоКГ)
- Виражена гіпертрофія лівого шлуночка (ЛШ) або окремих камер серця
- Електрична нестабільність серця (шлуночкова екстрасистолія ІІІ-V градацій, багатофокусна шлуночкова пароксизмальна тахікардія (ШПТ) або типу «пірует»). 10 поодиноких шлуночкових екстрасистол збільшують ризик РСС в 4 рази, а при поєднанні їх зі зниженням ФВ ≤ 40% – у 16 раз [8]
- Синоатріальна або АВ-блокада ІІ-ІІІ ступеня
- Синдром слабкості синусового вузла із синкопальними епізодами
- Порушення реполяризації (виражені зміни зубця Т на ЕКГ)
- Збільшення інтервалу Q-T > 0,44 с і дисперсія інтервалу Q-T
- Пізні потенціали шлуночків
- Зниження варіабельності ритму серця
- Гіпокаліємія і гіпомагніємія
Однак згідно з даними холтерівського моніторування ЕКГ, слід пам’ятати, що суправентрикулярні екстрасистоли зустрічаються у 14-91% здорових осіб, шлуночкові екстрасистоли – у 46-89%, міграція надшлуночкового водія ритму – у 8-54%, вислизувальні комплекси (МКХ 149.8) – у 4-46%.
Клінічні та інструментальні предиктори розвитку РСС наведені в таблиці 1.
Таким чином, необхідно розглянути основні чинники РСС.
ФШ – хаотичне аритмічне збудження та неефективне скорочення окремих м’язових волокон міокарда з дуже високою частотою (більше 300/хв). У 75-90% випадків безпосередньою причиною смерті є ФШ, яка в 80-85% випадків виникає після епізодів ШПТ, при цьому нерідко (25%) після розвитку тахікардії типу «пірует». Хворі на ХСН приблизно в 50% випадків помирають від ФШ.
Патогенез ФШ складний та до кінця не вивчений. Виникнення тріпотіння і ФШ зумовлене розвитком механізму re-entry. ШПТ трансформується в ФШ у 67,5% [1] випадків, що є найбільш частою причиною РСС [1, 13].
Клініка. Основними клінічними симптомами раптової зупинки кровообігу є:
- втрата свідомості;
- відсутність пульсу на сонних та стегнових артеріях;
- зупинка дихання;
- тонічні та клонічні судоми;
- розширення зіниць;
- сірувато-блідий відтінок слизових оболонок і шкіри.
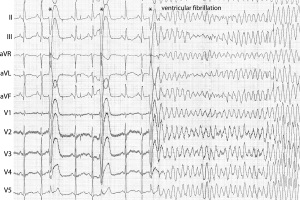
ЕКГ-діагностика ФШ наведена в алгоритмі 2.
Алгоритм 2. Стандарти ЕКГ-діагностики тріпотіння та фібриляції шлуночків
ЕКГ-критерії тріпотіння шлуночків
- Часті (250-300/хв) регулярні чи майже регулярні хвилі порівняно великої амплітуди, широкі осциляції, в яких неможливо визначити сегмент ST, зубці T, R i S
- Амплітуда хвиль однакова і нагадує синусоїдальну криву
ЕКГ-критерії фібриляції шлуночків
- Нерегулярні, неоднакової форми та амплітуди хвилі фібриляції з частотою більше 300/хв
- Комплекс QRS, сегмент ST і зубець T залежно від амплітуди хвиль важко диференціюються або не розпізнаються
- Ізоелектрична лінія не визначається
- Амплітуда хвиль фібриляції шлуночків має тенденцію до зменшення
Реанімаційні заходи при ФШ представлені в алгоритмі 3, асистолії – в алгоритмі 4, електромеханічної дисоціації – в алгоритмі 5.
Алгоритм 3. Стандарти послідовності реанімаційних заходів при фібриляції шлуночків
Крок 1. Діагностика раптової зупинки кровообігу
Крок 2. Зареєструвати ЕКГ, на якій при ФШ визначається крива неправильної форми, а зубці не піддаються диференціюванню
Крок 3. Покласти хворого на підлогу чи щит
Крок 4. Нанести різкий удар кулаком, занесеним приблизно на 20 см над грудною кліткою, по нижній третині грудини
Крок 5. Зробити непрямий масаж серця та штучне дихання із рота в рот чи із рота в ніс (у співвідношенні 30 : 2, як однією, так і двома особами) [3, 14], рекомендовані міжнародним консенсусом із серцево-легеневої реанімації (2005)
Крок 6. Провести електричну дефібриляцію розрядом 360 Дж (при поступовому збільшенні розряду відбувається втрата часу, тому ефективність її значно нижча)
Крок 7. Провести інтубацію трахеї та забезпечити венозний доступ
Крок 8.Ввести 1 мл 1% розчину (1 мг ) адреналіну в/в кожні 3-5 хв (не менше 1-2 разів). За відсутності венозного доступу адреналін вводять ендотрахеально по 2-2,5 мг
Крок 9. Знову проводять електричну дефібриляцію розрядом 360 ДЖ
Крок 10. Ввести 1 мг/кг лідокаїну в/в струменево або 5 мг/кг бретилію (орніду) в/в струменево
Крок 11. Знову проводять електричну дефібриляцію розрядом 360 Дж
Алгоритм 4. Реанімаційні заходи при асистолії (Grauer K., Covallаro D., 1996)
Крок 1. Непрямий масаж серця та штучне дихання із рота в рот чи із рота в ніс
Крок 2. Адреналін вводять у дозі 1 мг в/в чи ендотрахеально (2-2,5 мг). Дозу можна збільшувати за відсутності клінічного ефекту
Крок 3. Атропін вводять у дозі 1 мг в/в. Ін’єкції проводять кожні 3-5 хв до загальної дози 0,04 мг/кг маси тіла (3 мг)
Крок 4. Проведення ендокардіальної електрокардіостимуляції, чим раніше вона розпочата, тим вища її ефективність
Крок 5. Бікарбонат натрію при асистолії краще не вводити, якщо зупинка кровообігу не дуже тривала, чи вона виникла на тлі компенсованого ацидозу
Крок 6. Амінофілін (еуфілін, теофілін) вводять в/в струменево в дозі 250 мг упродовж 1-2 хв
Алгоритм 5. Послідовність реанімаційних заходів при електромеханічній дисоціації
Крок 1. Непрямий масаж серця та штучна вентиляція легень
Крок 2. Налагодити в/в інфузію
Крок 3. Адреналін у дозі 0,5-1 мг 1 : 10000 розчину в/в струменево, який вводять кожні 5 хв
Крок 4. Інтубація трахеї, яку проводять одночасно з іншими реанімаційними заходами
Крок 5. Можливе використання бікарбонату натрію (ефективність його сумнівна) в дозі 1 мекв/кг, можна вводити його кожні 10 хв у дозі, що становить половину від початкової
Актуальним питанням є вивчення ефективності антиаритмічної терапії залежно від ризику РСС при структурних змінах у міокарді (табл. 2).
Як видно з приведених даних, найбільш ефективна антиаритмічна терапія при 4-му і 5-му ступенях тяжкості ураження міокарда.
Асистолія – це зупинка в роботі серця, яка на ЕКГ відображається рівною лінією. Її клінічні прояви такі ж, як і при ФШ.
Електромеханічна дисоціація – це збереження електричної активності серця за відсутності його механічних скорочень, яка супроводжується раптовою зупинкою кровообігу.
Останнім часом велику увагу приділяють особливості профілактики РСС на тлі ХСН [1, 9, 11]. У рандомізованих клінічних дослідженнях (РКД) CIBIS – III переконливо доведено, що у пацієнтів віком ≥ 65 років із симптомами легкої чи середньої форми тяжкості стабільної ХСН і ФВ лівого шлуночка ≥ 35% бісопролол більш ефективно зменшував РСС протягом року порівняно з еналаприлом [11] за рахунок більшого пригнічення активності симпатичної нервової системи. В інших РКД доведено, що при ХСН β-адреноблокатори (β-АБ), інгібітори АПФ, антагоністи альдостерону (еплеренон) зменшують виникнення РСС, однак найбільш ефективний у цих випадках аміодарон, який має широкий спектр дії (блокує калієві, частково швидкі натрієві, повільні кальцієві канали та β-адренорецептори) [1-3, 12].
Таким чином, з метою первинної профілактики РСС (за відсутності злоякісних шлуночкових аритмій в анамнезі) у хворих із ХСН необхідно в першу чергу застосовувати β-АБ (метопролол сукцинат, карведилол, бісопролол, небіволол) та блокатори ренін-ангіотензин-альдостеронової системи (у першу чергу інгібітори АПФ чи антагоністи альдостерону). Якщо небезпечні шлуночкові аритмії є в анамнезі, то препаратом вибору є аміодарон. Однак найбільш ефективним методом вторинної профілактики РСС вважають імплантовані кардіовертери-дефібрилятори (ІКД).
Ефективність антиаритмічної терапії згідно з доказовою медициною і проведених РКД:
- У РКД V-HeFT за даними дворічного спостереження виявлено зниження смертності у хворих на ХСН на фоні прийому інгібітора АПФ еналаприлу порівняно з пацієнтами, що приймали комбінацію α-адреноблокатора гідралазину з ізосорбідом динітратом у результаті зменшення РСС, особливо в осіб із помірною СН.
- У результаті РКД RALES установлено, що терапія антагоністом альдостерону спіронолактоном у поєднанні з діуретиком, інгібітором АПФ та дигоксином супроводжувалася більш значним зменшенням загальної смертності, РСС. Вважають, що ця позитивна динаміка зумовлена нормалізацією вмісту калію в крові, регресом інтерстиціального фіброзу, викликаного альдостероном.
- Метааналіз РКД у хворих із підозрою на ІМ показав, що внутрішньовенне призначення магнію в ранньому періоді захворювання супроводжувалося зниженням смертності на 45%. Але в більш пізніх дослідженнях ефективність магнію при ІМ не підтвердилась.
- Тривале застосування інгібіторів фосфодіестерази (мілренон) у РКД PROMISE супроводжувалося підвищенням загальної смертності в результаті збільшення ЧСС, тому в такої категорії хворих їх застосовувати не можна.
- ААП ІА, ІВ, ІС класів виявилися нездатними в профілактиці РСС, про що свідчать численні РКД, а навпаки, її значно збільшують.
- Новий блокатор калієвих каналів дофетилід у РКД DIAMOND не зменшував РСС у хворих, що перенесли ІМ з дисфункцією ЛШ.
- У Канадському РКД САМІАТ і Європейському дослідженні ЕМІАТ вивчали вплив аміодарону у хворих із постінфарктним кардіосклерозом, ускладненим екстрасистолією. У цих дослідженнях аміодарон достовірно знижував ризик аритмічної та кардіальної смерті. Отже, аміодарон – це єдиний ААП, який безпечно та ефективно попереджував ризик РСС у результаті зменшення шлуночкової екстрасистолії. В іншому дослідженні показано, що допоміжне призначення β-АБ до терапії аміодароном приводить до підвищення профілактичного лікування в 2,2 раза за рахунок зниження аритмічної смерті та в 1,8 раза – ризику серцевої смерті.
Профілактика РСС за допомогою β-АБ і аміодарону наведена в таблиці 3.
Проведений ряд РКД із вивчення ефективності застосування штучних кардіовертерів-дефібриляторів у профілактиці РСС. Доведено, що ІКД більш ефективно попереджують розвиток РСС, ніж аміодарон при злоякісних шлуночкових аритміях. При цьому ААП попереджують виникнення РСС, а кардіовертери-дефібрилятори її купірують.
Первинна та вторинна профілактика РСС наведена в таблицях 4, 5.
У профілактиці РСС ліпофільні β-АБ не поступаються аміодарону (при ФШ не більше 40%) після перенесеного ІМ. Комбінація аміодарону з ліпофільними β-АБ найбільше знижує загальну смертність у хворих із післяінфарктним кардіосклерозом із дисфункцією лівого шлуночка за рахунок зменшення РСС [7].
Профілактичне лікування після успішно проведеної дефібриляції наведено в алгоритмі 6.
Алгоритм 6. Превентивне лікування після успішно проведеної дефібриляції серця, направлене на попередження постконверсійних аритмій
Крок 1. Лікування основного захворювання
Крок 2. Корекція іонних порушень клітинних мембран кардіоміоцитів:
- магнію сульфат – 1 г/добу в/в крапельно впродовж 2-3 днів
- панангін (аспаркам) – 20 мл в/в крапельно впродовж 3 днів, потім по 2 драже тричі на день протягом 2-4 тижнів
Крок 3. Корекція перекисного окислення ліпідів і антиоксидантна система захисту:
- кверцетин – 3 г/добу чи корвітин 2 мл в/м
- триметазидин – 60-75 мг/добу
Крок 4. Проведення антифібриляторної терапії за допомогою ААП чи інгібіторів АПФ:
- метопролол (атенолол) по 100-200 мг/добу
- бісопролол (конкор) у дозі 5-10 мг/добу
- аміодарон (кордарон, аритміл) по 200-400 мг/добу
- еналаприл або ліприл, чи периндоприл у дозі 10-20 мг/добу
- каптоприл по 50-75 мг/добу
Таблиця 6. Рекомендації Європейського товариства кардіологів у профілактиці РСС
Проведені багатоцентрові дослідження з доказової медицини свідчать:
- Призначення β-АБ, інгібіторів АПФ і статинів зменшує ризик РСС у пацієнтів, що перенесли ІМ, а у хворих із СН – інгібіторів АПФ (еналаприлу, каптоприлу, лізиноприлу тощо) та β-АБ (метопрололу, бісопрололу, карведилолу) та антагоністів рецепторів альдостерону (спіронолактону).
- РСС на 57% зменшує імплантація ІКД, яка є найбільш ефективною у профілактиці ФШ, однак через високу вартість апаратів для пацієнтів України вони малодоступні [1, 6, 12, 13].
Останнім часом встановлено, що ризик нанесення розрядів у хворих із високими факторами ризику РСС у комбінації з β-АБ та аміодароном достовірно нижчий, ніж при ізольованому застосуванні β-АБ [6].
Дослідження американських лікарів у хворих, що перенесли ІМ, показали, що у пацієнтів, які вживали морську рибу принаймні один раз на тиждень, відносний ризик РСС достовірно знижувався порівняно з тими, що їли рибу менше ніж 1 раз на місяць. Доведено, що вживання морських продуктів, які містять омега-3 поліненасичені жирні кислоти, було також пов’язане зі зменшенням ризику РСС.
У осіб, які регулярно виконують помірні фізичні навантаження (наприклад, робота в саду або прогулянка) чи вправи підвищеної інтенсивності протягом 60 хв на тиждень, РСС була приблизно на 70% нижчою, ніж у пацієнтів, які фізичні навантаження не виконували. Отримані дані свідчать, що для профілактики РСС необхідно використовувати регулярні та нерегулярні фізичні навантаження.
Однак надмірне та тривале вживання алкоголю підвищує ризик виникнення РСС.
Отже, застосування β-АБ, інгібіторів АПФ, статинів, аспірину, проведення імплантації кардіовертерів-дефібриляторів, вживання морської риби та виконання помірних фізичних навантажень достовірно збільшують тривалість життя, зменшують смертність та покращують якість життя.
Поряд із цим проведені в аритмології значні дослідження з доказової медицини дозволили встановити наступне:
У результаті рандомізованих плацебо контрольованих досліджень встановлено, що лідокаїн збільшує летальність у хворих після перенесеного ІМ. Мегадослідження CAST [1985-1995] переконливо довело, що при застосуванні енкаїніду, флекаїніду та етацизину смертність збільшується в 2,5 раза і більше при тривалому їх застосуванні. ААП ІІІ класу соталол, за даними дослідження SWORD (3 тис. хворих), також збільшує смертність у середньому в 1,7 раза у хворих на ІХС після перенесеного ІМ, ускладненого ХСН із ФВ ≤ 40%.
Під час багатоцентрового дослідження SPAF встановлено, що у хворих на ФП, ускладнену ХСН, після призначення хінідину сульфату або новокаїнаміду ризик смерті зростав у 5,8 раза.
У дослідженні DIAMOND (1 500 хворих) ААП І класу дофетилід, навпаки, виявився ефективним. Він попереджує виникнення ФП, що дало змогу уникнути повторної госпіталізації пацієнтів, але не кардіальної смерті.
Ефективність ААП ІІІ класу аміодарону вивчали у 13 рандомізованих дослідженнях, результати яких були зведені в метааналізі АТМА (понад 6 500 пацієнтів). Виявлено, що у хворих на ХСН після перенесеного ІМ при тривалому застосуванні аміодарону протягом 2,5 років спостерігалося зниження загальної смертності на 13%, а частоти РСС – на 29%. У дослідженнях ЕМІАТ, САМІАТ доведено, що при ХСН після застосування аміодарону відмічалося додаткове зниження ризику смерті через кардіальні причини в 1,8 раза, коли цей препарат комбінували з β-АБ.
У багатоцентровому дослідженні ESVEM (1993) було встановлено, що протиаритмічний препарат соталол більш ефективний порівняно з новокаїнамідом, пропафеноном, хінідину сульфатом, іміпраміном і пірменомом у пацієнтів із ШПТ. Проте гемодинамічні побічні ефекти соталолу обмежують перспективу його широкого застосування при ХСН.
Тривале застосування антагоністів альдостерону (спіронолактон у невеликих дозах – 25 мг/добу) при ХСН значно зменшує ризик смерті (у середньому на 29%). Аналогічні дані отримані в рандомізованому дослідженні ЕPHESUS (6 632 пацієнтів), коли при тривалому застосуванні іншого інгібітора альдостерону (еплеренону) у хворих на ІХС після перенесеного ІМ частота РСС зменшилася у середньому на 21-23%.
Однак при застосуванні ААП можуть виникати аритмогенні ефекти.
Фактори виникнення аритмогенних ефектів ААП:
- Дисфункція ЛШ збільшує ризик аритмогенної дії препаратів на 5-20% (окрім аміодарону).
- Вроджене та набуте подовження тривалості інтервалу Q-T (викликають ААП ІА і ІІІ класів).
- Поєднання ААП із дигоксином та діуретиками.
- Похилий та старечий вік.
- Гіпокаліємія, гіпомагніємія.
- Знижена функція нирок, печінки.
- ХСН ІІБ – ІІІ стадії.
Помилки та необгрунтовані призначення препаратів не рекомендовані доказовою медициною:
- Призначення ААП при функціональних аритміях може призвести до розвитку аритмогенного ефекту і ФШ. Слід враховувати співвідношення потенційної небезпеки і користі ААП.
- Згідно з результатами багатоцентрового дослідження CAST, ААП І класу (енкаїнід, флекаїнід, етацизин) не слід призначати хворим після перенесеного ІМ тривало, оскільки вони підвищують летальність у 2,5-3,6 раза порівняно з плацебо.
- ААП І класу не слід призначати при органічних захворюваннях серця (при некоронарогенних захворюваннях можна), оскільки вони негативно впливають на прогноз життя.
- Комбінована терапія здатна не тільки підсилювати дію ААП, але й сумарну побічну реакцію лікарських засобів.
- Найбільшою помилкою при проведенні профілактики тромбоемболічних ускладнень у хворих із постійною формою ФП є призначення аспірину замість антикоагулянтів непрямої дії (варфарину).
- Недостатня підготовка лікарів у проведенні медикаментозної чи електричної кардіоверсії при затяжному нападі ФП (застосування прямих і непрямих антикоагулянтів в адекватних дозах під необхідним контролем лікування).
Відомо, що після успішної реанімації хворий тривалий час знаходиться в критичному стані і може виникати післяреанімаційна хвороба, яка характеризується метаболічними порушеннями та синдромом поліорганної недостатності. Серед інших порушень провідними є післяреанімаційна дисфункція міокарда та центральної нервової системи, котра визначає високу ранню післяреанімаційну смертність. Однак ще не розроблено ефективного специфічного лікування післяреанімаційної хвороби [14]. Поряд із цим рання діагностика та швидка корекція артеріальної гіпотензії, гіпоксемії, підвищеного внутрішньочерепного тиску та профілактика таких ускладнень, як синдром дисемінованого внутрішньосудинного згортання крові, нозокоміальна пневмонія, гострий респіраторний дистрес-синдром, поліпшують виживання, ефективність яких, згідно з даними доказової медицини, переконливо доведено.
Література
- Воронков Л.Г. Внезапная сердечная смерть у больных с хронической сердечной недостаточностью // Укр. мед. часопис. – 2004. – № 1 (39). – С. 24-32.
- Денисюк В.И., Дзяк Г.В., Мороз В.М. Лечение аритмий сердца: Пути повышения эффективности и безопасности антиаритмических препаратов. – Винница – Днепропетровск: ГП ГКФ, 2005. – 640 с.
- Денисюк В.І., Денисюк О.В. Доказова внутрішня медицина: Таємниці, стандарти діагностики та лікування. – Вінниця: ДП ДКФ, 2006. – 704 с.
- Доказова медицина та огляд міжнародних консенсусів у лікуванні хвороб органів кровообігу // За ред. В.М. Коваленко. – К.: 2003. – 211 с.
- Зербіно Д.Д., Малик О.Р., Соломенчук Т.М. Раптова смерть в Україні і вплив кризових екологічних чинників // Серце і судини. – 2006. – № 1. – С. 41-49.
- Явелов И.С. Имплантация кардиовертера-дефибрилятора не устраняет необходимости в антиаритмических препаратах во вторичной профилактике угрожающих жизни желудочковых аритмий: Результаты исследования ОРТІС // Кардиология. – 2006. – № 3. – С. 74.
- Канарский С.Г., Старицкий А.Г., Божко А.А. Коррекция нарушений барорефлекторной чувствительности и эффективного предупреждения внезапной аритмической смерти у больных с постинфарктной дисфункцией левого желудочка // Кардиология. – 2004. – № 10. – С. 13-18.
- Кулешова Э.В., Демченко Е.А., Шляхто Е.В. Всегда ли внезапна внезапная сердечная смерть? // Вестник аритмологии. – 2005. – № 42. – С. 22-27.
- Мареев В.Ю. Возможно ли успешное предотвращение внезапной смерти у больных с хронической сердечной недостаточностью и дисфункцией левого желудочка. Препараты или аппараты? // Кардиология. – 2004. – № 12. – С. 4-15.
- Мороз В.М., Липницкий Т.Н. Экспериментальное моделирование патогенетических механизмов внезапной смерти при лечении больных блокаторами натриевых каналов // Росс. кардиол. журнал. – 2006. – № 3 (59). – С. 67-69.
- Новые результаты исследования CIBIS – III // Therapia. – 2006. – № 10. – С. 70-72.
- Сердечная недостаточность и аритмии. Часть 1. Желудочковые аритмии // Клиническая фармакология и терапия. – 2003. – № 12 (4). – С. 5-9.
- Сичов О.С. Раптова серцева смерть // Мистецтво лікування. – 2004. – № 9 (015). – С. 36-42.
- Шлапак І.П., Зозуля І.С., Пилипенко М.М Серцево-легенева реанімація: новітні напрямки досліджень // Острые и неотложные состояния в практике врача. – 2005. – № 1 (01). – С. 14-18.
 Киевское городское терапевтическое общество
Киевское городское терапевтическое общество Тема заседания: хроническая почечная недостаточность
 Сердечная недостаточность у детей
Сердечная недостаточность у детей
 Тиатриазолин в комплексном лечении хронической сердечной недостаточности, обусловленной артериальной гипертензией (укр)
Тиатриазолин в комплексном лечении хронической сердечной недостаточности, обусловленной артериальной гипертензией (укр)
 Концепция спиральной структуры сердца: новый этап в лечении сердечной недостаточности
Концепция спиральной структуры сердца: новый этап в лечении сердечной недостаточности
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення


