Современные данные изучения высокоаффинного рецептора иммуноглобулина Е
Высокоаффинный Fc-рецептор (FcεRI) иммуноглобулина (Ig) Е – важнейшая структура в развитии IgE-опосредованных аллергических реакций. FcεRI представляет собой мультимерный иммунный рецептор. Аллергический ринит, астма, атопический дерматит, пищевая и лекарственная аллергия, которые могут приводить к опасным для жизни анафилактическим реакциям, – растущая проблема современной медицины. Эти заболевания, как правило, являются клиническими проявлениями IgE-опосредованных реакций, в которых значительную роль играет FcεRI.
На сегодняшний день получены новые данные, существенно расширяющие понимание антигеннезависимых регуляторных механизмов в биологии FcεRI. Поверхностная экспрессия FcεRI, наличие которой необходимо для протекания аллергической реакции, усиливается при воздействии лиганда FcεRI (IgE и β-цепи самого FcεRI), в то время как продукты альтернативного сплайсинга β-цепи могут препятствовать экспрессии рецептора. Связывание IgE с FcεRI в некоторых случаях вызывает низко-уровневую рецепторную активацию и антигеннезависимые эффекты. Кроме того, в настоящее время описаны и изучены два различных пути сигнализации с участием FcεRI и новые ингибирующие рецепторы, что позволяет развивать новые подходы к лечению аллергических заболеваний.
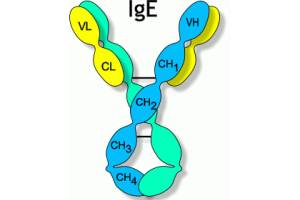
Строение FcεRI
FcεRI является мультимерным рецептором на клеточной поверхности, который с высокой афинностью связывает Fс-фрагмент IgE. Рецептор существует в форме три- и тетрамерного комплексов. В полной тетрамерной форме FcεRI содержит α-цепь (FcεRIα), β-цепь (FcεRIβ) и гомодимер γ-цепей, соединенных дисульфидным мостиком (FcεRIγ). Таким образом, тетрамер обозначается как αβγ2 (рис. 1).
Альфа-цепь принадлежит к суперсемейству иммуноглобулинов и состоит из двух внеклеточных иммуноглобулиновых доменов, которые связывают одну молекулу IgE, трансмембранного домена, содержащего консервативные остатки аспарагиновой кислоты, и короткого цитоплазматического хвоста [26]. Альфа-цепь гликозилирована для обеспечения соответствующего взаимодействия между собственно α-цепью и структурами, придающими необходимую конформацию в эндоплазматическом ретикулуме (ЭР). Цитоплазматическая часть α-цепи в сигнализации участия не принимает.
Кристаллографический анализ α-цепи и ее комплекса с Fc-фрагментом IgE показал, что этот комплекс весьма сложен и имеет структуру, объясняющую высокую аффинность FcεRI к IgE как результат низкой скорости диссоциации. Такая низкая скорость диссоциации обусловлена повышенной способностью каждого диссоциировавшего участка рецептора повторно связывать IgE, когда другие участки еще заняты IgE. Эти данные представляют особую важность в свете разработки новых стратегий воздействия на комплекс FcεRI. Можно предполагать, что вещество, которое способно нарушить свойства одного из связывающих участков, может быть достаточным для блокирования связывания путем усиления диссоциации IgE.
Бета- и гамма-цепи не играют существенной роли в связывании IgE. Каждая из них имеет ІТАМ-мотив (мотив активации иммунных рецепторов на основе тирозина), который фосфорилируется по тирозину после связывания антигена с молекулой IgE, присоединенной к рецептору. После этого наблюдается ассоциация β- и γ-цепей с внутриклеточными сигнальными молекулами через их SH2-домены [9]. Таким образом, β-цепь является только усилителем сигнала от FcεRI и его поверхностной экспрессии, а γ-цепи – главными сигнальными единицами. β- и γ-цепи могут использоваться другими Fc-рецепторами, например FcγRI, FcγRIII, FcαRI.
Регуляция экспрессии FcεRI
FcεRI достаточно широко представлен на поверхности клеток человеческого организма. Тримерный FcεRI присутствует на моноцитах, эозинофилах и дендритных клетках (ДК), в том числе клетках Лангерганса. Экспрессия FcεRI, состав которого еще не изучен, описана для нейтрофилов и тромбоцитов [17, 22, 27]. Уровень FcεRI, находящегося на поверхности клеток, определяет, какое количество аллергенспецифического IgE и соответственно аллергена сможет связаться с эффекторной клеткой для запуска аллергической реакции. Уровень экспрессии FcεRI-комплекса регулируется как другими рецепторными комплексами, так и лигандами (рис. 2).
Интерлейкин(ИЛ)-4 индуцирует продукцию незрелой коргликозилированной α-цепи FcεRI в эндоплазматическом ретикулуме. При отсутствии других цепей FcεRI-ком-плекса незрелые α-цепи задерживаются в ЭР. Неизвестные пока сигналы вызывают котрансляционную продукцию γ-цепей и классической полноразмерной β-цепи.
γ-цепи устраняют сигнал, задерживающий α-цепи в ЭР, приводя к экспорту тетрамерной структуры αβγ2 или тримерной αγ2 из ЭР. Этот процесс продолжается в комплексе Гольджи, где FcεRI окончательно гликозилируется, а затем транспортируется на поверхность клетки. Процесс протекает более эффективно для тетрамерного комплекса, который более стабилен на клеточной поверхности, чем αγ2. IgE стабилизирует FcεRI на поверхности клетки и ограничивает его интернализацию.
В человеческих тучных клетках и антигенпрезентирующих клетках (АПК) ИЛ-4, продуцирующийся Т-хелперами 2-го типа (Тх2), может усиливать экспрессию FcεRIα [13, 15, 33, 36]. Эти данные подчеркивают необходимость Тх2-цитокина ИЛ-4 для экспрессии FcεRI на клетках человека. У людей атопический статус коррелирует с поверхностной экспрессией FcεRI на тучных клетках, базофилах, моноцитах и ДК [18, 19, 30, 35, 57]. В человеческом организме αβγ2- и αγ2-комплексы присутствуют на тучных клетках и базофилах, αγ2-комплексы – на АПК и эозинофилах [1, 38].
IgE может оказывать регуляторный эффект на экспрессию FcεRI, что подтверждается корреляцией между уровнем сывороточного IgE и количеством IgE, связанного на базофилах. Позднее было установлено, что мономерный IgE способен увеличивать экспрессию FcεRI [23]. Уровень экспрессии FcεRI на тучных клетках IgE-дефицитных мышей возрастал после инкубации с IgE in vitro и при введении IgE in vivo [31]. Подобный феномен показан также для базофилов, моноцитов и ДК. Введение антител к IgE пациентам с атопией приводило к снижению уровня IgE и экспрессии FcεRI на базофилах [11]. Важен тот факт, что IgE-опосредованное увеличение экспрессии FcεRI вызывает усиление эффекторных функций клеток – высвобождения медиаторов из тучных клеток и антигенпредставляющей функции ДК [49].
Усиление экспрессии FcεRI на мембранах тучных клеток под действием IgE является следствием стабилизации рецепторов на мембранах. Такая стабилизация приостанавливает деградацию рецепторного комплекса – как тримерного, так и тетрамерного. Не обнаружено доказательств, что IgE повышает уровень транскрипции и транс-ляции FcεRI.
Биологические функции FcεRI
FcεRI, экспрессированный на поверхности тучных клеток и базофилов, играет ключевую роль в развитии реакций немедленного типа и в поздней фазе аллергических реакций. Это проявляется в высвобождении медиаторов (таких как гистамин, гепарин, нейтральные протеазы и др.), продукции лейкотриенов и простагландинов, синтезе цитокинов и хемокинов под действием перекрестного связывания антигеном комплексов FcεRI-IgE.
В живом организме развитие местных или системных реакций анафилаксии предотвращается у мышей, дефицитных по α- и β-цепям. Такие компоненты поздней фазы IgE-зависимого ответа, как отек тканей, отложение фибрина и накопление лейкоцитов, также зависят от тучных клеток и базофилов, несущих FcεRI [52]. Помимо этого, ныне активно изучаются антигеннезависимые эффекты связывания IgE с FcεRI и роль FcεRI в контактной гиперчувствительности.
Антигеннезависимые эффекты
Существуют данные, что IgE самостоятельно, без участия антигена, способен увеличивать выживаемость тучных клеток при культивировании в среде с дефицитом ростовых факторов [43, 53]. Этим может объясняться механизм влияния повышенного уровня IgE на усиление развития аллергических реакций – вследствие увеличения количества и жизнеспособности эффекторных клеток аллергии. Например, трансплантация мышам гибридомы, продуцирующей IgE, приводила к увеличению числа тучных клеток в желудке [16].
В литературе приводятся противоречивые данные о возможности IgE-опосредованной сигнализации – активации киназы, регулируемой внеклеточными сигналами (ERK); c-jun-N-терминальной киназы (JNK); р38- и АКТ (РКВ)-сигнализации – с последующей аутокринной секрецией цитокинов и индукцией антиапоптического белка ВСL-XL [43, 53]. Показано, что некоторые клоны IgE способны вызывать незначительную агрегацию FcεRI без сшивки антигеном, что приводило к таким типичным явлениям индукции FcεRI, как синтез и высвобождение гистамина, адгезия, миграция, синтез ДНК, которые наблюдаются после классической сшивки IgE-FcεRI-комплекса антигеном (активация селезеночной тирозинкиназы [SYK]) [32]. Аутокринная продукция ИЛ-3 наряду с повышенной экспрессией BCL-2 и BCL-XL, вероятно, являются основными компонентами увеличения выживаемости тучных клеток под действием цитокинергического IgE [51].
Существенно, что эффекты «мономерного» IgE, отли-чающиеся от агрегации FcεRI, могут быть угнетены действием гаптена. Вопрос о том, всегда ли при очень высоком уровне сывороточного IgE наблюдается незначительная агрегация FcεRI, остается открытым.
FcεRI на антигенпрезентирующих клетках
У человека тримерный FcεRIαγ2 экспрессируется профессиональными АПК, такими как ДК (включая эпидермальные клетки Лангерганса), моноциты и макрофаги. Поверхностная экспрессия этого рецепторного комплекса на указанных клетках усилена у пациентов с атопией и коррелирует с уровнем сывороточного IgE как маркер активности заболевания. Существующие данные демонстрируют, что FcεRI, экспрессируемый на АПК, играет важную роль в патогенезе и эффекторной фазе аллергического воспаления. Было показано, что моноциты и ДК пациентов с аллергией представляют аллергены пыльцы березы Т-клеткам более эффективно в присутствии специфического IgE, что приводит к проникновению антигена, связанного с комплексом IgE-FcεRI, в клеточные компартменты, где присутствуют молекулы главного комплекса гистосовместимости II класса, и представлению антигенного пептида [20, 48]. Тем не менее доказательств фундаментальной роли тримерного FcεRI на АПК в инициации и прогрессировании атопических заболеваний по-прежнему недостаточно.
Имеются данные, что FcεRI на АПК, подобно FcεRI на тучных клетках и базофилах, могут выполнять провоспалительную функцию у больных с аллергическими заболеваниями. Связывание FcεRI на моноцитах, клетках Лангерганса и других ДК пациентов с атопией может индуцировать активацию протеинтирозинкиназ, мобилизацию кальция и активацию провоспалительных транскрипционных факторов, таких как ядерный фактор kB (NF-kB) [14]. Это приводит к продукции нескольких провоспалительных и хемотактических факторов: фактора некроза опухоли (ФНО), СС-хемокинового лиганда-2 (CCL2, также известного как МСР1), ИЛ-1β, ИЛ-8, ИЛ-16, которые поддерживают воспалительный фон в тканях больных с атопией [4]. Например, продукция ИЛ-16, обусловленная связыванием FcεRI на клетках Лангерганса пациентов с атопическим дерматитом, может приводить к накоплению Т-хелперов, ДК и эозинофилов в участках кожи, подвергающихся воздействию аллергенов.
Связывание FcεRI на разных субпопуляциях ДК может оказывать различные воздействия на фенотип Тх-клеток. При этом клетки Лангерганса способствуют формированию Тх2-фенотипа, доминирующего в начальной фазе атопического дерматита, в то время как другие субпопуляции ДК, которые присутствуют только в уже сформированных участках воспалительного повреждения кожи, продуцируют ИЛ-12 и ИЛ-18 и могут поддерживать развитие Тх1-фенотипа, характерного для хронических повреждений при атопическом дерматите [6]. Обнаружено, что связывание FcεRI на плазмацитоидных ДК умень-шает их способность секретировать интерфероны α и β при стимуляции Тоll-подобных рецепторов-9, таким образом снижая их Тх1-поляризационные свойства.
FcεRI в реакциях гиперчувствительности замедленного типа
Роль тучных клеток в реакциях гиперчувствительности замедленного типа (ГЗТ), таких как кожная гиперчувствительность (КГ) к контакту с аллергеном, остается противоречивой [41], однако их значение в определенных аспектах кожной гиперчувствительности можно считать доказанным. Так, на модели мышей с дефицитом тучных клеток продемонстрировано, что ФНО и СХС-хемокиновый лиганд-2 (МІР2, функциональный аналог ИЛ-8), которые продуцируются тучными клетками, необходимы для привлечения полиморфноядерных лейкоцитов в очаги повреждения [42]. Роль IgE и FcεRI в этом исследовании не изучалась. Позднее было показано, что мыши с дефицитом IgE, тучных клеток и FcRg (у которых имелся также недостаток FcεRI и FcγRIII) проявляли достоверно сниженную кожную гиперчувствительность и имели уменьшенную инфильтрацию кожи (особенно нейтрофилами).
Установлено, что КГ может быть восстановлена введением IgE различной специфичности. Это указывает на то, что IgE посредством FcεRI на тучных клетках способен выполнять антигеннезависимую функцию в КГ, возможно, благодаря действию мономерного IgE на экспрессию FcεRI или продукцию цитокинов тучными клетками. У мышей с дефицитом продукции IgE наблюдается дефект фазы сенсибилизации, который характеризуется сниженным уровнем продукции протеазы тучных клеток-6 (МСР6), ИЛ-1β, ФНО и ССL2, что объясняет намного менее выраженную миграцию эпидермальных клеток при сенсибилизации у таких мышей [34]. Другой механизм поддержания воспаления при реакциях ГЗТ – IgE-FcεRI-стимулированная продукция лейкотриенов тучными клетками. Лейкотриен В4 (LТВ4), продуцируемый после антигензависимой сшивки FcεRI, выступает хемоаттрактантом для CD8+-эффекторных Т-клеток, однако неясно, может ли LТВ4 продуцироваться после низкоуровневой агрегации FcεRI мономерным IgE. Кроме того, возможным механизмом являeтся индукция экспрессии молекулы адгезии сосудистых клеток-1 (VCAM1) на эндотелии или селектинов и молекул межклеточной адгезии-1 (ICAM1) на лейкоцитах, например, вследствие продукции ФНО тучными клетками [28].
Современные данные о передаче сигнала от FcεRI
После связывания антигеном IgE, присоединенного к FcεRI, инициируется комплекс сигнальных реакций, который неизбежно приводит к реализации эффекторных функций [25]. β- и γ-цепи FcεRI содержат ITAM-мотивы, которые после фосфорилирования по тирозину связывают SH2-домены протеинтирозинкиназ (РТК), в основном киназ семейства SRC – LYN и FYN, а также SYK [24]. LYN и FYN ассоциированы с FcεRIβ, а SYK – с FcεRIγ. После сшивки FcεRI первичные сигнальные события инициируются LYN, которая при этом активируется и фосфорилирует ITAM-мотивы β- и γ-цепей. Затем к γ-цепи присоединяется SYK. LYN также способна трансфосфорилировать ITAM-мотивы в рядом расположенных FcεRI-рецепторных комплексах, вызывая усиление сигнала. Присоединение SYK к FcεRIγ приводит к LYN-зависимому фосфорилированию тирозина и активации SYK. Среди множества субстратов SYK следует выделить адапторные белки, связанные с активацией Т-клеток (LAT), и лейкоцитарный белок, содержащий SH2-домены, с массой 76 кД (SLP76) [40]. Эти адапторы далее принимают участие в формировании больших сигнальных комплексов, которые содержат другие молекулы, такие как протеинтирозинкиназа – тирозинкиназа Брутона (ВТК), активирующая фосфолипазу Сγ (PLCγ) совместно с SYK. В свою очередь это приводит к образованию диацилглицерола (ДАГ) и мобилизации Са2+, вызванной инозитол-1,4,5-трифосфатом (ИТФ) [62].
Изучение LYN-дефицитных костномозговых тучных клеток, которые демонстрировали нормальную дегрануляцию, показало существование компенсации другими молекулами или участие в дегрануляции второго сигнального пути [44]. В новейших исследованиях выявлено наличие дополнительного пути, инициирующегося FcεRI через FYN и связывающего белок-2 (GAB2), ассоциированный с адапторным белком-2, который связан с рецепторами факторов роста (GRB2). После связывания FcεRI FYN фосфорилирует GAB2, который активирует фосфоинозитид-3-киназу І класса (РІК3), а затем ряд последующих киназ, что приводит к дегрануляции. Следует отметить, что сигнальный путь, связанный с LYN, является критическим для Са2+-зависимой сигнализации, в то время как FYN-зависимый путь достаточен для дегрануляции и обеспечения кальциевой сигнализации. Оба пути требуют активации SYK, так как у SYK-дефицитных мышей отсутствует и мобилизация кальция, и дегрануляция тучных клеток [10].
ИТФ является хорошо охарактеризованным главным вторичным посредником мобилизации Са2+ в клетках иммунной системы. При передаче сигнала от FcεRI ИТФ продуцируется главным образом путем активации PLСg после активации SYK и BTK. ИТФ связывается с собственными рецепторами на мембране ЭР, которые являются кальциевыми каналами и высвобождают Са2+ из хранилищ ЭР в цитоплазму. Истощение хранилищ ЭР приводит к активации каналов плазматических мембран (SOC), которые, открываясь, обеспечивают вход Са2+. Поток Са2+ известен как ICRAC (кальциевый поток, активированный высвобождением кальция).
Другим вторичным посредником в реализации функций тучных клеток и мобилизации кальция является сфингозин-1-фосфат (СФ), который образуется путем фосфорилирования сфингозина сфингозинкиназами. Повышенный уровень СФ, коррелирующий с тяжестью воспаления, обнаруживается в дыхательных путях астматиков после местной провокации аллергеном [55]. Кроме того, внешнее воздействие СФ на тучные клетки индуцирует высвобождение медиаторов [58]. Тучные клетки, активируемые вследствие сшивки FcεRI, высвобождают СФ, который затем присоединяется к внеклеточным сфингозиновым рецепторам С1Р-1 и С1Р-2, а далее перекрестно активирует тучные клетки. Этот механизм обеспечивает реципрокную активацию и усиление аллергической реакции вследствие увеличения миграции тучных клеток в участки аллергического воспаления (С1Р-1) и их дегрануляции (С1Р-2) [61].
Сшивка FcεRI индуцирует сфингозинкиназную активность, которая определяет динамический баланс между сфингозином и С1Р («сфинголипидный реостат»): высокий уровень сфингозина ассоциирован с развитием апоптоза, а высокий уровень С1Р – наоборот, с пролиферацией.
Сигнальный путь митогенактивированной протеинкиназы (МАРК) и киназы, связанной с внеклеточными сигналами (ERK), активируется адаптором LAT, который вовлекает GRB2 и фактор обмена гуаниннуклеотида (SOS), индуцирующий RAS. RAS активирует FcεRI-индуцируемую продукцию липидных медиаторов через фосфолипазу А2 и продукцию цитокинов через транскрипционные факторы. Путем скрининга генов, активированных после сшивки FcεRI, был идентифицирован RAB-фактор-1 обмена гуаниннуклеотида (RABGEF1) – новый отрицательный регулятор сигнального пути, индуцированного FcεRI [50]. Тучные клетки мышей, дефицитных по RABGEF1, имели повышенную продукцию липидных медиаторов и цитокинов, а также усиленную FcεRI-индуцированную дегрануляцию.
Недавно была раскрыта роль трансмембранного адаптора со структурным сходством с LAT (также известного как NTAL (не-Т-клеточный активатор), LAB (активатор В-клеток), или LAT2) в сигнальном пути, связанном с FcεRI. Сшивка FcεRI приводит к быстрому LYN- и SYK-зависимому фосфорилированию NTAL [45]. У мышей, дефицитных по NTAL, наблюдается усиление FcεRI-индуцированной дегрануляции и синтеза цитокинов, что характеризует роль NTAL как отрицательного регулятора FcεRI-сигнального пути. Остается неясным, является ли это действительно подтверждением роли NTAL или результатом компенсации со стороны других молекул FcεRI-сигнального пути.
Если сигнальные пути немедленного ответа через FcεRI достаточно хорошо понятны, то сигнальные молекулы, участвующие в регуляции поздней фазы аллергического ответа, изучены намного меньше. FcεRI-индуцированная продукция цитокинов, лежащая в основе этой фазы, главным образом является следствием активации ядерного фактора активированных Т-клеток (NFAT), активаторного белка-1 (АР1) и транскрипционного фактора NF-kB [5]. Долгое время оставалась неясной связь между важными участниками сигнального каскада, запускаемого FcεRI: АКТ – с одной стороны и NF-kB, IKK (ингибитором киназы NF-kB) и IkB (ингибитором NF-kB) – с другой. В настоящее время выявлены белок В-клеточной лимфомы-10 (BCL-10) и транслокационный белок лимфомы-1, ассоциированный с лимфоидной тканью слизистых оболочек (MALT1) [59]. Эти два белка прямо связываются друг с другом и взаимодействуют в создании комплекса, опосредующего сигнал-специфическую активацию IKK в сигнальном пути от Т-клеточного рецептора. Мыши, дефицитные по BCL-10 и MALT1, имеют нормально функционирующий МАРК-каскад, дегрануляцию и высвобождение липидных медиаторов, однако пониженную продукцию провоспалительных цитокинов ИЛ-6 и туморнекротизирующего фактора. Соответственно такие мыши демонстрируют нарушения поздней фазы аллергического IgE-опосредованного ответа.
Влияние на функции FcεRI
ITIM-содержащие иммунные рецепторы. FcεRI-опосредованные эффекторные функции тучных клеток и базофилов регулируются также ингибиторными рецепторами клеточной поверхности [37]. Общей их характеристикой является наличие иммунорецепторного ингибиторного мотива, основанного на тирозине (ITIM). В зависимости от их внеклеточного домена эти рецепторы принадлежат либо к суперсемейству иммуноглобулинов, либо к суперсемейству лектинов С-типа (кальцийзависимых).
С помощью ITIM они угнетают активацию клеток усилением дефосфорилирования. Однако лиганды некоторых из этих рецепторов остаются неизвестными, а их функция установлена с помощью моноклональных антител.
Низкоаффинный рецептор IgG FcγRIIB связывает аллергенспецифический IgG и под действием соагрегации с аллергенспецифическим IgE, связанным с FcεRI, выключает сигнализацию через FcεRI и эффекторные функции тучных клеток и базофилов [37]. Способность IgG противодействовать IgE может лежать в основе механизмов успешной десенсибилизации аллергенами, хотя это еще требует подтверждения. FcγRIIB более широко распространен в тканях, чем FcεRI, включая В-клетки, и может также ингибировать ответы, вызванные IgG-рецепторами [37]. У мышей, дефицитных по FcγRIIB, проявляется усиленная FcεRI-опосредованная анафилаксия, наблюдаются более высокие уровни иммуноглобулинов (включая IgG1, который может вызывать у них анафилактические реакции) и пониженная назальная толерантность к аллергенам, что доказывает супрессивную роль FcγRIIB, реализующуюся путем ингибирования активации, опосредованной В-клеточным рецептором, и подавления функций АПК [54].
Не-ITIM-содержащие молекулы клеточной поверхности. Поверхностные молекулы, которые не содержат ITIM-мотив, также могут угнетать FcεRI-сигнальный путь. Антитела, специфичные к CD200R (рецептору для CD200, также известному как OX2) и члену суперсемейства иммуноглобулинов, подавляют FcεRI-опосредованную дегрануляцию тучных клеток и кожную анафилаксию, хотя механизмы этого явления остаются нераскрытыми. IgА-рецептор FcαRI, который ассоциирован с γ-цепью FcεRI, является ITAM-содержащим рецептором и способен ингибировать FcεRI-индуцированную дегрануляцию тучных клеток [29]. Этим могут объясняться противовоспалительный эффект IgА и повышенная чувствительность индивидуумов с IgА-дефицитом к аутоиммунным и аллергическим заболеваниям.
Антитела, специфичные к тетраспаниновым молекулам CD63 и CD81, супрессируют FcεRI-индуцированную дегрануляцию тучных клеток [60]. Тетраспанины не имеют известных внеклеточных лигандов или сигнальной способности, но формируют мембранную сеть между собой или с другими белками плазматической мембраны, такими как β-интегрины. Недавно обнаружено, что антитела к CD63 супрессируют развитие анафилаксии и ингибируют дополнительный GAB2-PIK3-сигнальный путь в тучных клетках, в то время как ранние события активации FcεRI-пути и мобилизация ионов кальция остаются без изменений [7]. Известно, что β-интегринзависимая адгезия тучных клеток усиливает их секреторные функции. Антитела к CD63 могут супрессировать адгезию тучных клеток к некоторым субстратам β-интегрина и эффективно предотвращать проявления анафилаксии в прилипающих тучных клетках.
Терапевтические аспекты
Ингибирование функций FcεRI может представлять ценность для разработки различных терапевтических подходов к лечению аллергических заболеваний. Моноклональные антитела к IgE эффективны в терапии астмы [46], аллергического ринита и пищевой аллергии к арахису [12]. Использование таких антител позволяет снизить концентрацию свободных молекул IgE в сыворотке крови аллергиков и уровень FcεRI на базофилах, тучных клетках и ДК [47]. Эти эффекты снижают вероятность связывания IgE с FcεRI и контакта IgE с аллергеном. Данный подход направлен на связывание молекул IgE различной специфичности, что расширяет возможности применения, но ограничивает эффективность.
Другая стратегия, использующая химерный fusion-белок, состоящий из одного IgE-Cε3-домена, и проапоптическую молекулу BAK (антагониста BCL-2), селективно направлена на разрушение клеток, экспрессирующих FcγRI (таких как базофилы, тучные клетки), путем индукции апоптоза [8].
Предположительно десенсибилизация аллергеном может быть основана на продукции аллергенспецифических IgG, которые связывают аллергены и заполняют FcγRIIB, выключая В-клетки, экспрессирующие специфические IgG, и IgE-опосредованный ответ тучных клеток и базофилов [56]. Однако десенсибилизация эффективна только для отдельной группы белков и иногда может приводить к развитию анафилаксии. Разработан новый подход, использующий ингибиторные функции FcγRIIB [1]. При этом применяются антитела двойной специфичности, состоящие из человеческого специфического Fab'-фрагмента IgЕ, связанного с человеческим специфическим Fab'-фрагментом FcγRIIB, для уменьшения IgЕ-FcεRI-индуцированной дегрануляции базофилов и тучных клеток. Получены результаты, свидетельствующие о том, что химерная молекула, состоящая из Fc-части человеческого IgG1 и связанная с Fc-частью человеческого IgЕ, ингибирует дегрануляцию, индуцированную FcεRI [3]. В настоящее время создана уникальная молекула, состоящая из Fc-фрагмента человеческого IgG1 и основного аллергена кошки Fel-d1 [2]. Такая молекула супрессирует дегрануляцию базофилов и тучных клеток, аллергенопосредованную анафилаксию и гиперреактивность бронхов с помощью аллергенспецифического IgЕ и кошачьего аллергена у трансгенных мышей, которым введен человеческий FcεRIα. Несмотря на то что химерные молекулы сами по себе не могут активировать дегрануляцию тучных клеток, существует опасность среди части пациентов, у которых активирующий FcγRIIА превалирует над FcγRIIB, как это бывает в случае полиморфизма гена FcγRIIB [21].
Таким образом, в данном обзоре сделана попытка в доступной форме изложить современные данные о сигнализации через FcεRI, регуляции экспрессии этого рецептора, взаимодействии с другими рецепторными путями, а также о возможных подходах к применению этих знаний для лечения аллергических заболеваний. Текущую информацию по данному вопросу отражает также блестящий аналитический обзор, опубликованный S. Kraft и J.-P. Kinet [39] из Гарвардского института медицины. Вышеуказанные сведения мы дополнили и преломили в рамках выполнения научно-исследовательской работы «Изучение переключения синтеза иммуноглобулинов…». Хочется надеяться, что факты, подходы и гипотезы, приведенные выше, заинтересуют как непосредственно аллергологов и иммунологов, так и специалистов смежных дисциплин: молекулярной биологии, биохимии, генетики, физиологии.
Список литературы находится в редакции
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Атопический дерматит: когда кожа становится уязвимой
Атопический дерматит: когда кожа становится уязвимой
 Цетрин в лечении экземы и атопического дерматита
Цетрин в лечении экземы и атопического дерматита
 Диагностика и лечение атопического дерматита у детей и взрослых: консенсус EAACI/AAAAI/PRACTALL*
Диагностика и лечение атопического дерматита у детей и взрослых: консенсус EAACI/AAAAI/PRACTALL*
 АСТЕМИЗОЛ-ЛХФЗ — современный антигистаминный препарат в лечении атопических заболеваний
АСТЕМИЗОЛ-ЛХФЗ — современный антигистаминный препарат в лечении атопических заболеваний