Побочное действие лекарственных средств. Дифференциальная диагностика аллергических, токсико-аллергических и псевдоаллергических реакций
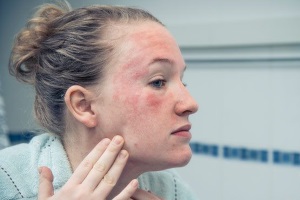
Побочное действие лекарственных средств (ПДЛС) продолжает оставаться одной из актуальнейших проблем клинической медицины, в том числе дерматологии, занимая четвертое место после болезней сердца, онкологических заболеваний и инсульта среди причин смерти [10]. ПДЛС – непреднамеренное действие, выходящее за рамки рассчитанного терапевтического эффекта, наблюдаемое при использовании лекарственного средства (ЛС) в рекомендуемых дозах [10].

Следовательно, несмотря на то что точно известны фармакологические действия каждого из 8000 зарегистрированных в Украине препаратов, возможность развития побочных реакций в большинстве случаев остается непредсказуемой.
Неуклонному росту числа побочных эффектов фармакотерапии способствует аллергизация населения за счет загрязнения экологической среды; постоянного контакта в быту и на производстве с разнообразными химическими веществами; полипрагмазия и самолечение, особенно на фоне стрессов. Немалый вклад в процесс аллергизации населения вносят пестициды и нитраты, обнаруживаемые в овощах, консерванты и различные пищевые добавки, антибиотики и гормональные средства в мясо-молочных продуктах, в которые они попадают при лечении больных животных или в качестве стимуляторов их роста. Возрастание уровня заболеваемости аллергозами связано также с увеличением численности людей, работающих на производствах с вредными условиями труда (химической, строительной, медицинской, бытовой, пищевой отраслей промышленности и т.д.), злоупотреблением высокоаллергенной пищей, употреблением продуктов быстрого приготовления, а также содержанием в домашних условиях животных и птиц.
Согласно данным Института иммунологии МЗ РФ, в общей структуре аллергических заболеваний аллергодерматозы составляют от 20 до 70% [5]. Однако эти цифры не соответствуют истинной распространенности аллергических заболеваний кожи, поскольку во всех странах, в том числе и в Украине, отсутствуют официальные статистические данные их регистрации. Что касается ПДЛС, то официальная статистика их распространенности также носит приблизительный характер. С целью ликвидации имеющихся пробелов в статистической отчетности в 2000 г. в Украине были приняты нормативные документы (приказы № 347 от 19.12.2000 г.; № 51 от 28.02.2001 г.; № 292 от 16.07.2001 г.), согласно которым медицинские работники обязаны информировать Центр медицинской статистики о всех выявленных случаях ПДЛС [4]. С 1996 по 2001 г. отделом фармакологического надзора Государственного фармакологического центра МЗ Украины получено 822 спонтанных сообщения о ПДЛС отечественного (52%) и зарубежного (48%) производства, преимущественно на сердечно-сосудистые (26%) и антимикробные (21%) препараты [1].
Общепринятой классификации ПДЛС до сих пор не существует. Из-за многообразия природы и механизмов развития осложнений фармакотерапии этиологический и клинико-описательный подходы оказались малоприемлемыми. Именно поэтому в основе большинства ныне действующих классификаций ПДЛС лежит патогенетический принцип, согласно которому выделяют несколько видов развития побочных эффектов [3]:
- фармакологическое побочное действие;
- токсический побочный эффект;
- побочное действие, обусловленное нарушением иммунной системы;
- псевдоаллергические реакции;
- канцерогенный эффект;
- мутагенное действие;
- тератогенный эффект;
- побочное действие, обусловленное массивным бактериолизом или изменением микробного пейзажа;
- фармакофобию.
Из всех видов ПДЛС в клинической практике наибольшее распространение получили реакции, обусловленные нарушением иммунной системы организма, – так называемыеистинные аллергические реакции. В последние годы также нередко встречаются токсико-аллергические и псевдоаллергические реакции, которые имеют сходные клинические проявления с аллергическими реакциями, но разные механизмы развития, с вытекающими отсюда различными подходами к реабилитации. Между тем в практическом здравоохранении в качестве повседневной нормы сложилась парадоксальная ситуация, когда разные виды реакций, определяемые соответствующими терминами, часто трактуют как одну аллергическую реакцию, т.е. фактически в разные понятия вкладывается одно содержание, вследствие чего между различными нозологическими единицами ставится знак равенства и не проводится дифференциальная диагностика. Вместе с тем одно и то же понятие подменяется различной терминологией и сутью. Например, аллергическую реакцию на ЛС называют токсико-аллергической реакцией, токсидермией, нежелательным или отрицательным действием. В российских стандартах диагностики и лечения в понятие острой токсико-аллергической реакции на медикаменты включены крапивница (L50), многоформная экссудативная эритема (L51) и анафилактический шок (Т88.6) [5]. В стандартах дерматовенерологической практики семейного врача ставится знак равенства между лекарственной аллергией и токсидермией, которые рассматриваются как дерматит, вызванный принятыми внутрь ЛС, адекватно назначенными и правильно примененными (L27) [12]. Между тем интернистами еще со времен Е.М. Тареева истинные аллергические реакции оценивались не как симптом или синдром аллергического процесса, а как отдельная нозологическая единица – лекарственная болезнь (ЛБ) [2, 14]. В МКБ-10 болезнь, обусловленная ЛС, также выделена в отдельную рубрику (D59) [8]. О целесообразности рассмотрения аллергических реакций на ЛС как лекарственной (второй) болезни, а не симптома или синдрома свидетельствуют и многолетние клинико-экспериментальные исследования Института дерматологии и венерологии АМН Украины. Основанием для этого утверждения являются данные о вовлечении в аллергический процесс всех систем организма, несмотря на то, что клинически заболевание может протекать с преимущественным поражением одной из них, чаще всего кожи [13]. Лекарственная (вторая) болезнь может развиться на фоне любого патологического процесса при повторном приеме среднетерапевтических доз ЛС, при этом она обусловливается не столько фармакологическими характеристиками самого препарата, сколько особенностями иммунной системы больного и его конституционально-генетической предрасположенностью. Основу патогенеза ЛБ составляют иммунологические механизмы, которые можно разделить на 4 типа (реагиновый, цитотоксический, иммунокомплексный, гиперчувствительности замедленного типа), каждый из которых имеет 3 стадии (иммунологическую, патохимическую и патофизиологическую) с особенностью течения процесса в иммунологической стадии.
Согласно концепции Института дерматологии и венерологии АМН Украины, у лиц с конституционально-генетической предрасположенностью в ответ на кратковременный или длительный прием ЛС развивается острый или хронический стресс, что проявляется конформационными изменениями в белковой структуре цитоплазмы клеток. В свою очередь, стресс на фоне гипокинезии, постоянных эмоциональных нагрузок, психических травм, различной соматической или инфекционной патологии приводит к нарушению функциональной деятельности диэнцефально-стволовой области головного мозга, в частности гипоталамуса. В результате изменяется выработка соответствующих либеринов, стимулирующих выделение гормонов гипофиза: усиливается продукция адренокортикотропного гормона (АКТГ) и нарушается секреция гонадотропных гормонов. Это проявляется сдвигами в андрогенно-эстрогенном равновесии, что делает организм чувствительным к воздействию всех аллергенов, в том числе лекарственных. Увеличение выделения АКТГ на ранних этапах усиливает секрецию глюкокортикоидов корой надпочечников и рассматривается как выражение защитно-компенсаторных реакций, направленных на поддержание гомеостаза. При продолжающемся воздействии аллергенов развивается несостоятельность защитно-компенсаторных механизмов, происходит истощение резервных возможностей коры надпочечников. О последнем свидетельствует низкий уровень тирозина в крови больных на фоне высокого содержания кортизола. Активно включается в защитно-компенсаторные реакции тиреоидная система как одно из важнейших звеньев адаптации, что подтверждается изменениями содержания в плазме общего тироксина и трийодтиронина. Как выражение компенсаторных реакций, направленных на поддержание гомеостаза, повышается функциональная активность симпатико-адреналовой системы. Вследствие сдвигов нейроэндокринной регуляции у больных развиваются изменения в микроциркуляторном, кислотно-щелочном, водно-электролитном гомеостазах, в содержании некоторых микроэлементов, а также в активности ферментов. Стресс и нарушение механизмов нейроэндокринной регуляции изменяют нормальное течение процессов перекисного окисления липидов, приводят к снижению активности антиоксидантной системы, особенно глутатионового ее звена. Понижается неспецифическая резистентность, а также функциональная активность Т- и В-систем иммунитета. В итоге на фоне приема ЛС по поводу любого соматического, кожного или инфекционного заболевания развивается латентная сенсибилизация, формируется склонность к аутоагрессии и иммунодепрессии, которые играют ведущую роль в патогенезе лекарственной болезни. При этом, как показали исследования последних лет, при иммунодефиците, как и при аутоиммунных состояниях, развивается чрезмерная активация иммунокомпетентных клеток. Однако если при иммунодефиците их активность приводит к гибели (апоптоз), то при аутоагрессии – к накоплению аутореактивных клонов (отсутствие апоптоза) [13].
Благоприятные условия для развития сенсибилизации возникают преимущественно у лиц с особым фенотипом ферментных систем, в основном при сниженной активности ацетилтрансферазы печени или фермента глюкозо-6-фосфатдегидрогеназы эритроцитов.
Выделяют три основных фактора риска развития ЛБ [6], связанных:
- с природой ЛС и его применением (аллергенность препарата, доза, способ введения, длительность и частота курсов терапии);
- с организмом больного (указания в анамнезе на полипрагмазию и самолечение; психотравмы, эмоциональные стрессы; нервные и психические заболевания; аллергические заболевания; осложнения после введения вакцин и сывороток; длительный контакт по роду своей профессии с медикаментозными и химическими средствами; плохая переносимость пыльцы деревьев, трав, парфюмерии, красок; эндокринная патология; хронические соматические заболевания, особенно патология желудочно-кишечного тракта, болезни печени, почек; инфекционные заболевания, в том числе микозы и онихомикозы кистей и стоп, а также наличие очагов хронической инфекции; отягощенная наследственность);
- с сопутствующей медикаментозной терапией, поскольку известно, что некоторые препараты обладают адъювантными свойствами и повышают риск развития сенсибилизации. Зависимости между дозой принятого ЛС и развитием сенсибилизации, как и между химическим составом лекарственного препарата и клинической картиной заболевания, отметить, как правило, не удается. В то же время имеются указания на более частое развитие аллергических реакций на медикаменты при полипрагмазии, т.е. у больных, применяющих одновременно большое количество ЛС [9]. Аллергические свойства ЛС в значительной мере зависят от их химической структуры, при этом способность индуцировать иммунный ответ возрастает по мере увеличения молекулярной массы и сложности молекулы. Имеет значение способ введения ЛС: наименее опасен пероральный прием препарата, в то время как при внутримышечном введении частота аллергических реакций составляет 1-2%, при аппликации – 5-12%, при ингаляциях – 15% [7].
ЛБ чаще всего развивается на фоне лечения соматических нарушений, особенно желудочно-кишечного тракта (37%), простудных заболеваний (28%), патологии нервной (5%) и эндокринной (3%) систем, а также заболеваний мочевыводящей системы (2%) [13].
В последние годы участились случаи регистрации ЛБ среди больных распространенными дерматозами (25%), что делает эту проблему еще более актуальной для дерматологов. Так, по данным клиники Института дерматологии и венерологии АМН Украины, ЛБ регистрируется у пациентов с псориазом (8,2%), экземой (5,8%), аллергическим и атопическим дерматитом (1,3%), крапивницей (1,2%), васкулитом (1,1%), микозом и онихомикозом кистей и стоп (0,9%), пиодермитами (0,9%), красной волчанкой (0,8%), нейродермитом (0,7%), ретикулезом (0,5%), эритродермией (0,4%) и пузырчаткой (0,3%) [13].
Реагиновый (I) тип аллергической реакции выявляется у 37% пациентов, поражение иммунными комплексами (III тип) – у 3%, гиперчувствительность замедленного вида (IV) – у 60%, в то время как проявления по цитотоксическому (II) типу регистрируются довольно редко.
Многообразие иммунологических типов выражается полиморфизмом клинических проявлений. Так, в клинической классификации аллергических реакций на ЛС выделяют [3, 6, 9]:
- генерализованные (мультисистемные) поражения (анафилактический шок, сывороточная болезнь, лимфаденопатии, лекарственная лихорадка);
- поражения преимущественно кроветворных органов (тромбоцитопения, эозинофилия, гемолитическая анемия, агранулоцитоз);
- поражения преимущественно кожи:
- часто встречающиеся (по типу крапивницы и отека Квинке, розового лишая Жибера, экземы, различных экзантем);
- менее часто встречающиеся (по типу многоформной экссудативной эритемы; пузырных высыпаний, напоминающих дерматит Дюринга; васкулита; дерматомиозита);
- редко встречающиеся (синдром Лайелла, синдром Стивенса-Джонсона);
- поражения преимущественно отдельных органов (легких, сердца, печени, почек, желудочно-кишечного тракта);
- поражения главным образом нервной системы (энцефаломиелит, периферический неврит).
Основой диагностики ЛБ принято считать клинические критерии, из которых наиболее важными являются:
- установление связи клинических проявлений с приемом ЛС;
- эффект элиминации аллергена;
- персистирование симптомов заболевания при повторном применении этого же ЛС, при этом выраженность аллергической реакции увеличивается, а снижение дозы не предотвращает реакцию;
- хорошая переносимость ЛС в прошлом (наличие латентного периода сенсибилизации);
- отягощенный индивидуальный и семейный аллергологический анамнез;
- полиморфизм клинических проявлений;
- терапевтический эффект гипосенсибилизирующих средств.
Несмотря на то что подтверждением диагноза служат циклическое течение процесса и довольно быстрая его ремиссия после отмены плохо переносимого ЛС, все же имеются трудности в дифференциальной диагностике ЛБ с основным заболеванием, за осложнение которого ее часто и принимают. Особенно сложно дифференцировать ЛБ от различных заболеваний кожи, поскольку ее кожные проявления имеют большое сходство с клиникой многих истинных дерматозов (рис. 1-2, 3).
Не меньшие трудности в постановке диагноза по клиническим критериям возникают из-за сходства клинических проявлений ЛБ с таковыми токсико-аллергических и псевдоаллергических реакций на ЛС, а также некоторых инфекционных процессов (корь, краснуха, скарлатина, рецидивный сифилис) и с фармакофобиями. Трудности верификации ЛБ по клиническим проявлениям диктуют необходимость ее поэтапной диагностики с обязательным определением этиологии [13]:
- сбор аллергологического анамнеза с проведением общего клинико-лабораторного и иммунологического обследования;
- дифференциальная диагностика:
- ЛБ с истинными дерматозами;
- ЛБ с токсико-аллергическими реакциями;
- аллергических и псевдоаллергических реакций на ЛС;
- ЛБ с некоторыми инфекционными заболеваниями (корь, скарлатина, краснуха, ветряная оспа, вторичный свежий и рецидивный сифилис);
- ЛБ с фармакофобиями;
- специфическое иммунологическое обследование с целью выявления этиологического фактора аллергического процесса.
Дифференцировать кожные проявления ЛБ от истинных дерматозов помогают данные аллергологического анамнеза, особенно когда имеется четкая взаимосвязь между приемом ЛС и появлением обильных кожных высыпаний. Однако окончательный диагноз позволяют поставить только данные специфических иммунологических или биофизических тестов, с помощью которых удается либо опровергнуть, либо подтвердить ЛБ, выявив ее причинный фактор.
О токсическом побочном действии ЛС свидетельствуют: передозировка препаратов; недостаточность функций печени и почек, которые обусловливают кумуляцию лекарств в связи с нарушением элиминации; выявление ферментопатий, при которых отмечается замедление метаболизма терапевтических доз лекарств. Поскольку в основе токсико-аллергических реакций, как правило, не лежит иммунологический конфликт, то их диагностика строится на основе данных аллергологического анамнеза (указание на прием больным высоких или повышенных доз ЛС, в том числе не соответствующих возрасту; перенесенные в прошлом или имеющиеся в настоящем заболевания печени и почек; ферментопатии) и клинической картины, для которой наряду с кожной сыпью характерны симптомы гастроэнтеропатии (боль в брюшной полости, диарея, метеоризм) (рис. 4). При этом специфические иммунологические тесты с лекарственными препаратами, которые по анамнезу могли вызвать токсико-аллергическую реакцию, отрицательны. Содержание общего и специфического иммуноглобулина (Ig) Е в сыворотке крови, как правило, находится в пределах нормы.
Трудность дифференциации ЛБ от псевдоаллергических реакций на ЛС связана с тем, что, несмотря на то что в основе патогенеза псевдоаллергических реакций лежит не иммунный конфликт, а совсем другие механизмы (гистаминовый, нарушения активации комплемента и метаболизма ненасыщенных жирных кислот, в первую очередь арахидоновой), они по своим клиническим проявлениям ничем не отличаются от аллергических и токсико-аллергических реакций на ЛС [11]. Дифференциальная диагностика ЛБ и псевдоаллергических реакций строится главным образом на субъективных критериях: отсутствии периода сенсибилизации по данным аллергологического анамнеза; кратковременной продолжительности псевдоаллергических реакций; отсутствии повторных реакций при применении сходных в химическом отношении препаратов [11]. Из объективных критериев имеют преимущественное значение специфические иммунологические тесты, которые при псевдоаллергических реакциях, как правило, отрицательны [11] (табл.).
Подобные сложности возникают при верификации фармакофобий – навязчивых переживаний страха с четкой фабулой развития аллергического состояния на прием любого ЛС. Помогают в проведении дифференциальной диагностики отрицательные результаты специфических иммунологических тестов и положительные результаты внутрикожной пробы с физиологическим раствором.
Иногда ЛБ приходится дифференцировать с ложной поливалентностью, которая развивается в основном у лиц с диэнцефальным синдромом, повышенной нервной возбудимостью. Период сенсибилизации к ЛС у них, как правило, отсутствует, аллергологический анамнез не отягощен, специфические иммунологические тесты с предполагаемыми лекарственными аллергенами отрицательны, хороший эффект оказывает седативная гипносуггестивная терапия.
Наибольшие трудности имеются при постановке этиологического диагноза ЛБ, когда встает вопрос об идентификации из множества применявшихся ЛС в период проведения комплексной терапии того препарата, который оказался виновным в развитии аллергического состояния.
Этиологическая диагностика с помощью кожных проб как метода in vivo вызывает много дискуссий ввиду опасности для жизни больных и отсутствия нормативной базы для их применения в течение длительного времени [13]. Для постановки кожных проб существует много противопоказаний и ограничений, к тому же кожные пробы с лекарственными аллергенами малоинформативны из-за частых ложноположительных и ложноотрицательных результатов.
Противопоказаниями для постановки кожных проб являются [4, 7, 9, 10]:
- острый период любого аллергического заболевания;
- указание в анамнезе на анафилактический шок, синдромы Лайелла, Стивенса-Джонсона;
- острые инфекционные заболевания;
- обострение сопутствующих хронических заболеваний;
- декомпенсированные состояния при болезнях сердца, печени, почек;
- заболевания крови, онкологические, системные и аутоиммунные болезни;
- судорожный синдром, нервные и психические заболевания;
- туберкулез и вираж туберкулиновых проб;
- тиреотоксикоз;
- тяжелая форма сахарного диабета;
- беременность, период лактации, первые 2-3 дня менструального цикла;
- возраст до трех лет;
- период лечения антигистаминными препаратами, мембраностабилизаторами, гормонами, бронхоспазмолитиками.
К факторам, ограничивающим применение кожных проб, относятся [7, 13, 15]:
- невозможность с помощью данного метода заранее прогнозировать развитие побочных эффектов, не опосредованных IgЕ;
- непригодность для постановки кожных проб нерастворимых препаратов;
- длительность выполнения при поэтапной постановке, особенно если учесть, что пробу в любой модификации можно ставить только с одним ЛС в день;
- ограничение диагностической ценности кожных проб коротким промежутком времени.
Причины ложноположительных результатов кожных проб с лекарственными препаратами [13]:
- повышенная чувствительность капилляров кожи к механическому раздражению;
- неспецифическое раздражающее действие аллергенов вследствие неправильного их приготовления (аллерген должен быть изотоническим и иметь нейтральную реакцию);
- трудность дозирования вводимого аллергена;
- чувствительность к консервантам (фенолу, глицерину, мертиоляту);
- метааллергические реакции (положительные реакции в определенный сезон года с аллергенами, на которые больные в другое время года не реагируют);
- наличие общих аллергенных группировок между некоторыми аллергенами;
- использование для разведения ЛС нестандартизированных растворов.
Причины ложноотрицательных результатов кожных проб с лекарственными препаратами [13]:
- отсутствие необходимого лекарственного аллергена;
- потеря ЛС аллергенных свойств вследствие его длительного и неправильного хранения или в процессе разведения, поскольку до сих пор нет стандартизированных лекарственных аллергенов;
- отсутствие или снижение чувствительности кожи больного, вызванное:
а) отсутствием кожно-сенсибилизирующих антител;
б) ранним этапом развития повышенной чувствительности;
в) истощением запаса антител в период или после обострения заболевания;
г) снижением реактивности кожи, связанным с нарушением кровоснабжения, отеком, дегидратацией, влиянием ультрафиолетовой радиации, преклонным возрастом;
д) приемом больным непосредственно перед тестированием антигистаминных препаратов; - невозможность воссоздать на коже реакцию, адекватную той, что происходит в организме пациента из-за того, что:
а) большинство ЛС являются гаптенами – неполноценными аллергенами, которые приобретают свою полноценность только тогда, когда связываются с альбуминами сыворотки крови;
б) все ЛС в организме претерпевают ряд метаболических превращений, при этом сенсибилизация развивается, как правило, не на сам препарат, а на его метаболиты.
Однако кожные пробы, несмотря на их опасность для жизни больных, малоинформативность из-за частых ложноположительных и ложноотрицательных результатов, многих противопоказаний, а также факторов, ограничивающих их применение, продолжают широко использоваться в практическом здравоохранении, получив для этого в последние годы нормативную базу (приказ МЗ Украины от 02.04.2002 г. № 127 «Про організаційні заходи по впровадженню сучасних технологій діагностики та лікування алергічних захворювань») [4].
Ввиду спорности вопроса о постановке кожных проб и их опасности для здоровья ведущая роль в этиологической и дифференциальной диагностике ЛБ отводится результатам специфических иммунологических и биофизических тестов.
Критериями выбора метода in vitro являются: специфичность, чувствительность, незначительная трудоемкость, доступность, быстрота постановки и безопасность для жизни. Выбор метода in vitro вызывает не меньше спорных вопросов, чем кожные пробы как один из методов in vivo. Прежде всего, это связано с тем, что ни один из методов in vitro не позволяет в 100% случаях дать однозначный ответ, даже при использовании более 2-3 из них. Однако главная трудность специфической диагностики с помощью методов in vitro связана с тем, что большинство лекарственных препаратов становятся истинными антигенами (гаптенами) лишь после прочного соединения с собственными белками организма или их расщепления в организме. Кроме того, до сих пор отсутствуют стандартизированные диагностические лекарственные аллергены, вследствие чего приходится работать с аллергенами, характеризующимися различными физико-химическими параметрами, для которых не всегда возможно подобрать оптимальные концентрации, а также их растворители.
Из недостатков специфических иммунологических тестов следует отметить длительность их постановки, отсутствие у большинства учреждений практического здравоохранения необходимой материальной базы (вивария, радиоиммунной лаборатории, люминесцентного микроскопа, иммуноферментного анализатора, возможности приобретения дорогостоящих тест-систем и т.д.) [13]. Ввиду проблемы выбора метода специфической диагностики этап постановки этиологического диагноза является самым дискуссионным в аллергологии и клинической иммунологии.
С учетом всего вышесказанного в последние годы в этиологической диагностике стали отдавать предпочтение биофизическим экспресс-тестам, основанным на оценке:
- максимума интенсивности сверхслабого свечения сыворотки крови, предварительно инкубированной с предполагаемым лекарственным аллергеном и индуцированной перекисью водорода;
- скорости наступления гемолиза эритроцитов в присутствии предполагаемых лекарственных аллергенов;
- уровня поглощения ультразвука в эритроцитах, предварительно инкубированных с предполагаемым лекарственным аллергеном;
- скорости оседания эритроцитов в присутствии предполагаемых лекарственных аллергенов.
Сравнительный анализ традиционных иммунологических и биофизических экспресс-методов свидетельствует, что предъявляемым критериям диагностики наиболее полно отвечают биофизические методы, а из иммунологических методов – выявление специфических IgE с помощью иммуноферментного анализа (ИФА). Так, если специфический аллерген, являющийся причиной развития ЛБ, выявляется с помощью ультразвукового метода, автоматизированного метода седиментации эритроцитов, биохемилюминесценции сыворотки крови, индуцированной перекисью водорода, а также ИФА соответственно у 91,5; 90,3; 84,0 и 82% больных, то с помощью непрямого теста Шелли – у 81,8%, теста лимфобластической трансформации – у 71,7%, реакций агломерации и альтерации лейкоцитов – у 69,9%, специфического розеткообразования – у 65,1%, кислотных эритрограмм – у 61,5%, специфического подавления ретракции кровяного сгустка – у 54,8% обследованных. При этом длительность постановки биофизических экспресс-методов и ИФА сокращается до 20-30 мин вместо 1-3 сут при постановке традиционных иммунологических методов.
Протокол полного комплекса методов обследования, обеспечивающих этиологическую диагностику всех видов гиперчувствительности, должен включать [3, 6, 13, 15]:
- выявление реакций анафилактического, IgE-зависимого типа;
- определение IgE, связанных с базофилами;
- регистрацию иммунокомплексных реакций;
- определение реакции цитотоксического типа;
- диагностику Т-клеточных замедленных реакций.
Таким образом, комплекс специфических иммунологических и биофизических тестов служит существенным дополнением к клиническим критериям дифференциальной диагностики ПДЛС. Лабораторные методы выявления сенсибилизации к ЛС по безопасности и возможности их использования в любой период заболевания остаются более предпочтительными в отличие от кожных проб, которые не несут достоверной информации о наличии сенсибилизации и которые нельзя использовать в острой стадии кожного процесса, а главное, при постановке которых есть опасность развития анафилактического шока и летального исхода.
Литература
- Викторов О.П. Алергічні реакції на лікарські засоби: сучасні проблеми // Зб. наукових праць співробітників НМАПО ім. П.Л. Шупика. – Вип. 11, книга 2. – К., 2002. – С. 484-493.
- Грачева Н.М. Лекарственная болезнь в клинике инфекционных заболеваний. – М.: Медицина, 1978. – 199 с.
- Дранник Г.Н. Клиническая иммунология и аллергология: пособие для студентов, врачей-интернов, иммунологов, аллергологов, врачей лечебного профиля всех специальностей. – 3-е изд., доп. – К.: ООО «Полиграф плюс», 2006 – 482 с.
- Збірник нормативно-директивних документів з охорони здоров’я. – К.: Київський міський науковий інформаційно-аналітичний центр медичної статистики, 2002. – 120 с.
- Иммунопатология и аллергология. Стандарты диагностики и лечения / Под ред. Р.М. Хаитова. – М., 2001. – 96 с.
- Клиническая аллергология: Руководство для практических врачей / Под ред. Р.М. Хаитова. – М.: МЕДпресс-информ, 2002. – 624 с.
- Клиническая иммунология и аллергология: Пер. с англ./ Под ред. Г. Лолора-младшего, Т. Фишера и Д. Адельмана. – М.: Практика, 2000. – 806 с.
- МСКХ та споріднених проблем охорони здоров’я Х перегляду. – Женева (ВООЗ), 2001. – Т. 3. – С. 579.
- Новиков Д.К. Клиническая аллергология: Справ. пособие. – М.: Высш. шк., 1991. – 511 с.
- Паттерсон Р., Грэммер Л.К., Гринбергер П.А. Аллергические болезни: диагностика и лечение: Пер. с англ. / Под ред. А.Г. Чучалина. – М.: ГЭОТАР Медицина, 2000. – 768 с.
- Пыцкий В.И. Псевдоаллергия // Тер. архив. – 1991. – Т. 63. – № 3. – С. 133-137.
- Савчак В.І., Хара О.І. Стандарти дерматовенерологічної практики родинного лікаря: Метод. рекомендації. – Тернопіль, 2002. – 29 с.
- Солошенко Э.Н. Лекарственная болезнь как актуальная социальная и клиническая проблема // Доктор. – 2005. – № 1 (27). – С. 36-39.
- Тареев Е.М. Лекарственная болезнь, аналог сывороточной болезни // Советская медицина. – 1955. – № 3. – С. 3-10.
- Чернушенко Е.Ф. Лекарственная аллергия // Зб. наукових праць співробітників НМАПО ім. П.Л. Шупика. – Вип. 11, книга 2. – К., 2002. – С. 525-534.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Аллергия при беременности
Аллергия при беременности
 Патогенез побочных реакций при фармакотерапии
Патогенез побочных реакций при фармакотерапии
 На распутье дорог: нежелательная беременность - делать или не делать аборт?
На распутье дорог: нежелательная беременность - делать или не делать аборт?
 Лечение рассеянного склероза: современные достижения и реальность
Лечение рассеянного склероза: современные достижения и реальность