Рак щитоподібної залози: уроки останніх десятиріч
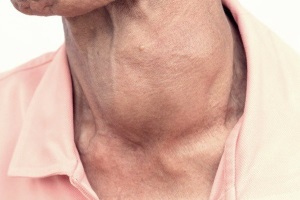
Вивчення проблеми раку щитоподібної залози (РЩЗ) і розробка ефективних методів його діагностики й лікування є одним із пріоритетних напрямів сучасної ендокринної хірургії, ендокринології та онкології. Кількість хворих, прооперованих із приводу РЩЗ в Україні, неухильно зростає і становить близько 2400 осіб на рік, тобто 5 на 100 тис. населення.
Проте в деяких регіонах, наприклад у м. Києві й Київській області, частота захворювання сягає 12 на 100 тис. населення, значно перевищуючи світові показники. Проблема РЩЗ, як лакмусовий папірець, перевіряє здатність вітчизняної медицини до прогресивних кроків, насамперед організаційного характеру, тобто поліпшення ефективності без суттєвих матеріальних затрат, але шляхом запровадження та дотримання сучасних науково обгрунтованих протоколів діагностики та лікування.

Радянський підхід...
Ще 20 років тому мало хто в СРСР і в Україні зокрема серйозно замислювався над необхідністю кардинально нових підходів у лікуванні РЩЗ: по-перше, через відносну рідкісність цієї патології (менше 1% всіх злоякісних пухлин людини), по-друге, через розповсюджене уявлення щодо «доброякісності» цієї онкологічної хвороби. Як діагностували та лікували РЩЗ у той час?Крім рідких випадків занедбаних форм раку (з шийними метастазами або симптомами проростання пухлини в гортань, трахею, гортанні нерви, стравохід, шкіру), більшість пацієнтів лікувалося з приводу вузлового зоба. Практично будь-який хворий на вузловий зоб вважався пацієнтом хірургічної клініки. Більш чи менш спеціалізовані хірургічні заклади залюбки бралися за лікування цих випадків практично без додаткових гормональних чи морфологічних обстежень. Багато хірургів надавали перевагу операції через її невисоку затратну частину, можливість виконання під місцевим знеболенням та швидке одужання пацієнтів. Крім випадків тиреотоксикозу чи зоба великого розміру, що спричинював компресію суміжних органів (загалом не більше 20% усіх тиреоїдних хворих), хірурги у своїх поспішних діях щодо так званих вузлів щитоподібної залози керувалися високою ідеєю «онкологічної перестороги». Таким чином, кожне вузлове утворення в щитоподібній залозі (що спостерігаються не менше, ніж у 10% населення) розцінювали як потенційний рак.
Що ж відбувалося далі? Щитоподібна залоза підлягала екзекуції: один чи кілька вузлів видалялися без будь-якої системи чи плану, найчастіше шляхом енуклеації або резекції частки довільного об’єму. При цьому насамперед прагнули зберегти максимум паренхіми залози для відновлення її функції, а також уникнути специфічних ускладнень тиреоїдної хірургії: пошкодження гортанних нервів (із наступною втратою голосу та погіршання дихання) та прищитоподібних залоз (із відповідним розвитком гіпопаратиреозу, гіпокальціємії та судом). Найкращий спосіб уникнути травми нервів та прищитоподібних залоз – триматися від них якнайдалі. Отож і висікалися, вирізалися, викроювалися разом із «вузлами» шматки щитоподібної залози. Однак при цьому чомусь забували про високу первинну мету: врятувати хворого від можливого раку, що «маскувався» під діагнозом вузлового зоба.
Діагноз РЩЗ переважно виникав лише після гістологічного дослідження препарату через 7-10 діб після операції. Зазвичай, це завжди було несподіванкою, адже експрес-біопсія практично ніколи не проводилася. Відсоток діагнозів РЩЗ був дуже низьким (5-10%) та розчинявся у потоці «невинних» доброякісних вузлів щитоподібної залози. Операція у вигляді резекції однієї чи двох часток щитоподібної залози аж ніяк не могла вважатися радикальною з онкологічного погляду (пухлина може мати багатофокусний характер, метастазувати в лімфовузли шиї чи поширюватися на зовнішні здорові ділянки залози), лімфатичні вузли шиї профілактично не досліджувалися та систематично не видалялися.
Однак повторні операції з видалення решти щитоподібної залози не виконували через великий ризик операційних ускладнень в умовах післяопераційної рубцевої та запальної інфільтрації, порушених анатомічних взаємовідносин структур шиї. Доводилося покладатися на «доброякісний» характер перебігу РЩЗ та зовнішнє рентгенівське опромінення шиї з метою радіаційного винищення пухлинних клітин (хоча вже давно доведено неефективність і навіть шкідливість рентгенівського опромінення при диференційованих формах РЩЗ).
Згідно з офіційними статистичними даними окремих клінік тих часів ефективність такого підходу до лікування була просто чудовою, особливо порівняно з іншими формами раку людини. Смертність не перевищувала 5-10% за перші 5-10 років, ускладнень майже не спостерігали, відсоток рецидивів та повторних втручань був у межах 10%.
Проте насправді точною статистикою могли оперувати лише деякі установи, та й вони простежували результати не більше половини хворих протягом 10 років. Природний повільний характер розвитку найпоширеніших папілярних та фолікулярних типів РЩЗ приховував розвиток рецидивів та метастазів пухлини, відтягував їх на довгі роки, маскував іншими захворюваннями. За 10-15-20 та більше років пацієнти змінювали місце проживання, роботу, хворіли на інші недуги та мали високу ймовірність померти від причин, не пов’язаних із тиреоїдною патологією. За тривалий час, що минав з першої операції, змінювалися й лікарі, а відсутній реєстр хворих не давав змоги стежити за долею кожного з пацієнтів. Отже, і фігурувала у звітах клінік «красива» статистика повного виліковування хворих на РЩЗ.
...і його ефективність
Як сьогодні з позицій сучасної медицини можна оцінити вищенаведений підхід до лікування РЩЗ та що ж відбувалося з хворими на рак після нерадикальних операцій насправді? Відповіді на ці запитання можна отримати, ознайомившись із результатами ретельного моніторингу за кількома тисячами занесених до комп’ютерної бази даних хворих на рак у США та Японії протягом 40-60 років.
З’ясувалося, що серед хворих, які отримали лише хірургічне лікування довільного обсягу, не менше 6% помирає за перші 10 років та 10-12% – за 35-40 років, рецидив хвороби виникає у 15% за перші 10 років та у 35-40% – за 40 років спостереження. Підвищення радикалізму операцій, запровадження комбінованого підходу в лікуванні із застосуванням терапії тироксином та радіоактивним йодом дає змогу зменшити рівень смертності за 20-35 років на кілька відсотків, а рівень рецидивів – до 8-9%. На сьогодні в США близько 300 тис. хворих на РЩЗ пройшли лікування та живуть без ознак хвороби.
Щодо алгоритму хірургічного лікування, який вітчизняні лікарі на різних рівнях відстоюють і досі (аж до відомих фахових інститутів), то він не витримує навіть поверхневої критики.
Розглянемо головні контраргументи, які наразі не викликають заперечень у всього прогресивного світу, але так болісно сприймаються вітчизняними майстрами скальпеля, особливо тими, хто працює на периферії.
Наслідки консерватизму
Насамперед зауважимо щодо так званого полювання хірургів – рятівників від раку – на хворих із вузлами в щитоподібній залозі: лише об’єктивізація діагнозу на доопераційному етапі може зменшити кількість зайвих операцій із приводу численних цілковито доброякісних та не шкідливих для здоров’я тиреоїдних вузлів.
Основним методом доопераційної діагностики є тонкоголкова пункційна біопсія з наступним цитологічним дослідженням клітин тиреоїдного епітелію та їх ядер. Для цього потрібен досвідчений цитолог, який виконує не менше кількасот досліджень щороку та має змогу порівняти свої результати з гістологічним дослідженням видалених препаратів. Дуже важливим на цьому етапі є гормональне дослідження хворих, адже пацієнти з гіпертиреозом мають дуже низький ризик виявлення у них РЩЗ, натомість підвищений базальний та стимульований рівні кальцитоніну крові достовірно вказують на наявність медулярної карциноми щитоподібної залози.
Ультразвукове дослідження надає багато інформації щодо можливості злоякісності тиреоїдного вузла – кальцифікати, нерівність контурів гіпоехогеннх вузлів, збільшені та близькі до сферичної форми лімфатичні вузли шиї, особливо в середній та нижній третинах бічного судинного пучка шиї з боку ураження щитоподібної залози. Проте ця інформація має лише допоміжний характер і не може слугувати остаточним методом діагностики.
Таким чином, основним критерієм показань до операції при невеликих вузлах щитоподібної залози (що не викликають місцевих симптомів), які не мають проявів автономного викиду в кров надлишку тиреоїдних гормонів, є висновок лікаря-цитолога відносно ядерно-клітинних характеристик пунктату тиреоїдних вузлів. Такі висновки можуть мати три основні варіанти: цілковито доброякісні (вірогідність помилки не перебільшує 2-5%), цілковито злоякісні (помилка майже виключена), підозрілі на рак пунктати (вірогідність раку при заключному гістологічному дослідженні сягає 30-70% залежно від кваліфікації цитолога та застосування допоміжних імуноцитохімічних критеріїв). Висновок «неінформативний пунктат» (5-8% випадків) потребує виконання повторних біопсій та цитологічних досліджень тиреоїдних вузлів.
Шляхом подібної селекції сьогодні можна відсіяти понад 60% цілковито доброякісних та безпечних для тривалого спостереження тиреоїдних вузлів. Водночас відсоток пацієнтів, що оперуються з приводу тиреоїдного раку чи підозри на рак серед усіх операцій на щитоподібній залозі, в провідних спеціалізованих клініках світу зріс із 10-15 до 40-50%. Отже, слід приділяти більшу увагу хворим на РЩЗ, одночасно рятуючи тисячі пацієнтів від непотрібних хірургічних втручань із неминучими типовими наслідками будь-якої операції (операційна травма, рубець, дискомфорт), ризиком тяжких специфічних ускладнень (парез гортані, гіпопаратиреоз) та втратою тиреоїдної функції.
Крім структури операцій на щитоподібній залозі (переважне оперування хворих із онкологічними показаннями до втручання), змінилися принципи самої тиреоїдної хірургії.
Можна лише дивуватися консерватизму хірургів, які обрали своїм об’єктом щитоподібну залозу. Адже ще в 1938 р. відомий американський хірург Lahey довів, що шляхом систематичного пошуку, візуалізації та виділення гортанних нервів можна зменшити рівень їх ушкодження та частоту парезів гортані до мізерної цифри (0,3%) порівняно з 10% під час операцій, що виконуються за звичайною методикою.
Цей історичний приклад демонструє відмінності результатів при застосуванні різних хірургічних технік. Об’єктивно проведені дослідження в багатьох авторитетних клініках світу (зокрема й в Україні) показали високий рівень післяопераційних ускладнень у випадку втручань на щитоподібній залозі «всліпу» (без попереднього виділення гортанних нервів) – 8-12% пошкоджень поворотних гортанних нервів та парезу гортані. Ця цифра не відповідає традиційним статистикам вітчизняних клінік, але при їх «втішних» результатах операцій на щитоподібній залозі в жодному випадку не проводилося об’єктивної ларингоскопічної реєстрації функції гортані після хірургічного втручання.
Сучасна тиреоїдна хірургія
Як же зменшити ризик ускладнень тиреоїдної хірургії? Потрібно оперувати анатомічно: спочатку визначити об’єкти, які необхідно залишити недоторканними (гортанні нерви, прищитоподібні залози), виділити, зберегти їх цілісність та кровопостачання, а потім видалити частку або всю щитоподібну залозу з пухлиною (пухлинами).
Перехід на цей шлях є природним та неминучим для всіх ендокринних хірургів, навіть якщо їх становлення відбувалося під впливом традиційної для України школи «консервативної» органозберігаючої тиреоїдної хірургії з субфасціальною методикою оперування.
Освоєння нових методичних підходів у хірургії щитоподібної залози має відбуватися в умовах стажування в клініках, де подібну тактику взято на озброєння. Цей процес може бути значно полегшено шляхом застосування під час операцій новітнього методу електро-функціонального нейромоніторингу гортанних нервів. Метод полягає в інтраопераційному стимулюванні гортанних нервів імпульсним електричним струмом низької сили (0,5-1 мА) через тонкий металевий зонд. Електричний стимул подразнює голосові зв’язки та м’язи гортані. Їх реакція передається на дві пари електродів, закріплених на спеціальній інтубаційній ендотрахеальній трубці. Зміна електричного опору на цих електродах сприймається комп’ютерним блоком та виводиться на монітор у вигляді осциляцій і дублюється звуковим сигналом. Таку методику вперше в Україні було впроваджено в Українському науково-практичному центрі ендокринної хірургії МОЗ України в результаті плідної співпраці з Гарвардським медичним університетом та Масачусетським загальним шпиталем (Бостон, США). Ця хірургічна технологія, розроблена фірмою Medtronic, Xomed (США), неодноразово довела свою виняткову корисність під час складних (особливо повторних) операцій з приводу РЩЗ, дала змогу уникнути прикрих ускладнень, які можуть зробити інвалідами людей голосових професій.
Питання безпечності операції тісно пов’язане з обсягом резекції щитоподібної залози. Саме ризик ускладнень у разі повного видалення частки або всієї щитоподібної залози стримує багатьох хірургів, дає привід відстоювати так звані функціональні резекції цього органу. Однак очевидно, що збереження 3-5 г тиреоїдної тканини, особливо при виконанні резекції однієї частки залози, не поліпшить функціональних результатів, але призведе до серйозних проблем у випадку рецидиву чи необхідності виконання радикальної тиреоїдектомії при раковій пухлині. Зважаючи на це, мінімальним обсягом операції на щитоподібній залозі в усіх випадках тиреоїдних пухлин визнано гемітиреоїдектомію (видалення однієї частки залози), а при двобічному ураженні – тиреоїдектомію (з неминучою необхідністю довічного прийому тиреоїдних гормонів). Це вважається меншим злом, ніж ризик рецидиву хвороби при так званих органозберігаючих операціях, коли гормональна недостатність щитоподібної залози в більшості випадків все одно виникає.
Іншим аргументом на користь тотальної тиреоїдектомії при ракових пухлинах є можливість та ефективність проведення допоміжного лікування за допомогою радіоактивного йоду за умови повного видалення всієї тиреоїдної паренхіми. Лише терапія радіоактивним йодом дає шанс на виліковування хворим із віддаленими метастазами (середостіння, легені, кістки, печінка тощо). Цей метод також дуже ефективний при лікуванні мікрометастазів у лімфатичних вузлах шиї. За різними даними частота ураження метастазами лімфатичних шийних вузлів коливається в межах 30-80%, що робить неприпустимим традиційне стримане ставлення хірургів до виконання дисекції шляхів лімфатичного відтоку від щитоподібної залози. Адже без інформації щодо ураження лімфатичних вузлів та призначення відповідного додаткового лікування (хірургічної дисекції шиї або терапії радіоактивним йодом) пацієнти приречені на рецидив раку, а 30% хворих із рецидивом РЩЗ помирають протягом 5 років.
Отже, хірургічна операція при тиреоїдному РЩЗ чи підозрі на нього має носити радикальний та превентивний характер (відносно потенційних рецидивів хвороби), інакше пацієнта очікуватимуть повторні операції, дуже небезпечні в плані ускладнень, ефективність яких значно зменшуватиметься, а ризик смерті від раку суттєво зростатиме.
Можливості лікування диференційованого РЖЗ
Повільний розвиток диференційованих ракових пухлин щитоподібної залози (85-90%) вимагає пожиттєвого нагляду за пацієнтами. Сучасний моніторинг хворих на РЩЗ полягає у визначенні рівня специфічного лише для тиреоїдної тканини білка крові – тиреоглобуліну, періодичного ультразвукового дослідження та сканування всього тіла з використанням радіоактивного йоду. Такі заходи можуть бути застосовані знову ж таки лише за умов повного видалення тиреоїдної тканини та метастазів пухлини на шиї. Зрозуміло, що за старих підходів до хірургічного лікування тиреоїдних вузлів і РЩЗ можливість застосування такого протоколу майже виключена. Пацієнти залишаються сам на сам зі своїми проблемами, можливий рецидив РЩЗ буде розпізнано лише в разі клінічних проявів хвороби (великій пухлині, скаргах, деформації шиї метастазами), коли побороти недугу буде майже неможливо.
Сучасні світові підходи до лікування диференційованого РЩЗ передбачають виконання первинної радикальної операції (тиреоїдектомії з систематичним видаленням уражених лімфатичних вузлів шиї) з мінімальним ризиком ушкодження гортанних нервів та прищитоподібних залоз (менше 1% кожне). Доповнення операції специфічним променевим лікуванням радіоактивним йодом, який знищує залишки клітин щитоподібної залози чи її диференційованих пухлин, а також не помічених та не видалених мікрометастазів, дає змогу досягти «чистого біохімічного аркуша» крові пацієнта відносно тиреоглобуліну – специфічного білка тиреоцитів. Подальший контроль рівня цього білка в організмі хворих дає змогу вчасно виявити рецидив раку. Сканування всього тіла після застосування радіоактивного йоду є ефективним способом локалізації метастазів (регіонарних та віддалених) папілярного та фолікулярного РЩЗ – найпоширеніших його типів. Але в разі нульового (або майже нульового) рівня тиреоглобуліну крові необхідність у скануванні значно скорочується та може застосовуватися раз на кілька років. Функція щитоподібної залози компенсується прийомом надфізіологічних (супресивних щодо гіпофізарного тиреотропного гормону) доз тиреоїдних гормонів (тироксину) – близько 2,5 мкг на 1 кг ваги. Таке лікування необхідно контролювати за рівнем тиреотропного гормону крові – він має бути нижчим за 0,5 мОд/л. На жаль, прийом тироксину потрібно припиняти на 4-6 тижнів для підготовки до терапевтичного чи діагностичного застосування радіоактивного йоду, а також для більш інформативного визначення рівня тиреоглобуліну крові. Для цих випадків рівень тиреотропіну має бути більшим за 30 МО/л.
Останнім часом з’явилася можливість уникнути всіх небажаних ефектів тривалої відміни тироксину з розвитком кількатижневого важкого гіпотиреозу. Синтезований у США рекомбінантний генно-інженерний штучний тиреотропін людини нещодавно з’явився і в Україні. Дві послідовні ін’єкції цього препарату дають змогу досягти дуже високого рівня тиреотропіну в крові (150-200 МО/л) та проводити терапію чи діагностичне сканування з радіоактивним йодом, не припиняючи прийом тироксину. До речі, саме в Українському науково-практичному центрі ендокринної хірургії уперше в Україні було застосовано підготовку до проведення сканування хворих на РЩЗ із радіоактивним йодом за допомогою цього препарату.
Подолання проблеми тиреоїдного раку
Розглянемо етапи подолання проблеми тиреоїдного раку протягом останніх 20 років в Україні та світі.
Минуло понад 20 років після аварії на Чорнобильській АЕС, радіаційні наслідки якої зумовили великий інтерес медичних працівників та громадськості всього світу до проблем тиреоїдного раку, насамперед серед дітей. Координація зусиль науковців і лікарів різних ланок охорони здоров’я дала змогу розробити найдоцільніший алгоритм діагностики та лікування пухлин щитоподібної залози в дітей, переглянути застарілі підходи і стереотипи відносно розвитку, перебігу та лікування радіаційно-індукованого тиреоїдного раку. Переконливо доведено більш агресивний перебіг радіаційно-індукованого раку щитоподібної залози у дітей та необхідність більш радикального та методичного його лікування.
В останні роки кількість нових випадків РЩЗ серед дітей та підлітків різко зменшилася (майже до рівня, що спостерігався до Чорнобильської катастрофи). Суттєво зменшилась і частота випадків РЩЗ серед пацієнтів, які були дітьми на момент аварії. Проте прогресує поширеність РЩЗ серед понад мільйонного контингенту людей, які зазнали впливу чорнобильської радіації у дорослому віці (ліквідатори аварії, евакуйовані, мешканці забруднених територій).
Разом із цим на сьогодні проблема РЩЗ в Україні вийшла далеко за межі наслідків чорнобильської катастрофи і характеризується зростанням захворюваності на цю патологію та значним поглибленням знань науковців і лікарів світу щодо патогенезу тиреоїдного раку, можливостей контролю над ним, а також і суттєвим відставанням української медицини від загальноприйнятих стандартів діагностики та лікування РЩЗ, відсутністю загальнодержавних консенсусів, які б відповідали в цьому напрямі світовій практиці.
Слід зазначити, що питання діагностики, лікування та моніторингу РЩЗ мультидисциплінарні й вимагають комплексного підходу через певні специфічні особливості патології. Насамперед РЩЗ – це на 90% високодиференційована форма пухлини (папілярний чи фолікулярний різновид раку), що зберігає такі ендокринні властивості, як залежність від регулюючого впливу тиреотропного гормону гіпофіза (ТТГ), здатність до накопичення атомів йоду і синтезу тиреоглобуліну (ТГ). Це дає змогу підвищити ефективність хірургічного лікування таких пацієнтів за допомогою руйнування залишків пухлини чи метастазів радіоактивним йодом та супресивної (відносно ТТГ) терапії тироксином, а також контролю виліковування за рівнем ТГ та діагностичним скануванням з ізотопами йоду. Тривалий та повільний перебіг захворювання навіть за відсутності лікування, можливість рецидиву не лише в перші п’ять, але й через 30-40 років роблять надзвичайно важливими об’єктивний та точний довгостроковий моніторинг за пацієнтами, а також дбайливе ставлення до якості життя хворих.
Менш поширений (5-10%) та агресивніший медулярний РЩЗ, що походить із С-клітин, також є гормонально активною пухлиною, що дає змогу раннього розпізнавання її за ознаками підвищення рівня кальцитоніну крові, а також тривалого моніторингу активності процесу за цим же показником.
Найнебезпечніша з пухлин щитоподібної залози та одна з найагресивніших форм раку людини – анапластичний РЩЗ, що характеризується повною втратою ознак диференціювання тиреоцитів і становить 2-5% усіх випадків тиреоїдного раку, сьогодні демонструє очевидну безпорадність засобів комбінованого лікування та стимулює пошуки засобів подовження терміну виживання пацієнтів.
Отже, загальновизнаними складовими ефективного лікування РЩЗ є хірургічне втручання на щитоподібній залозі та лімфатичних вузлах шиї, променева терапія (тропними до тиреоцитів ізотопами або інколи зовнішнім опроміненням), гормоно- та хіміотерапія. Не виключено, що незабаром стане можливим застосування генетичних засобів попередження та лікування цієї хвороби.
За останні 10-15 років провідними центрами з дослідження РЩЗ у світі зроблено рішучі кроки в напрямі розшифровки генетичних основ тиреоїдного канцерогенезу, зокрема й радіаційно-індукованих пухлин, локалізовано причинні мутації в генах, що відповідають за розвиток спадкової форми медулярного раку та множинних ендокринних неоплазій (МЕН-синдромів), доведено високу ефективність лікування високодиференційованих форм РЩЗ радіоактивним йодом, синтезовано рекомбінантний тиреотропін людини, який дає змогу застосовувати ізотопи йоду з діагностичною та лікувальною метою без припинення супресивної терапії тироксином, активно досліджуються можливості використання радіоактивних ізотопів у лікуванні медулярного РЩЗ, отримано обнадійливі дані щодо підвищення здатності тиреоцитів до акумуляції йоду у випадках зниження диференціювання пухлин.
У хірургічному лікуванні РЩЗ закріпилися радикальні підходи, засновані на тотальній екстрафасціальній тиреоїдектомії з візуалізацією усіх життєво важливих анатомічних структур, що мають ризик бути пошкодженими. Втручання на лімфатичних колекторах та застосування ад’ювантних методів лікування залежить від доопераційної та інтраопераційної оцінки прогностичних факторів за однією з кількох відомих систем прогнозу. Статистична обробка багатотисячних баз даних спостереження за хворими на РЩЗ, удосконалення та систематизація критеріїв моніторингу за пацієнтами довели можливість повного виліковування більшості хворих, тривалої ремісії навіть занедбаних випадків високодиференційованого РЩЗ. Розробка ефективного генетичного та біохімічного скринінгу медулярного РЩЗ дає змогу виявити хворобу та виконати операцію на ранніх стадіях процесу (або навіть ще до початку малігнізації – профілактично, в ранньому дитячому віці серед носіїв мутованого RET-протоонкогену), що також забезпечує оптимістичний тривалий прогноз для життя.
Такий всебічний прогрес у питаннях діагностики та лікуванні РЩЗ ілюструють результати лікування РЩЗ у розвинутих країнах світу. Так, у США смертність від РЩЗ за останні 30 років зменшилася на 50%.
Проблема тиреоїдного раку в Україні
На жаль, навіть неповні звітні статистичні дані свідчать про щонайменше 3,5-4 разове перевищення рівня смертності від РЩЗ в Україні порівняно з США: на 20 тис. нових випадків та 290 тис. всіх зареєстрованих хворих у США спостерігається 1500 смертних випадків на рік; в Україні на 2 тис. нових випадків та 20 тис. зареєстрованих хворих помирає 450-500 пацієнтів щороку. Відсутня точна статистика охоплення пацієнтів України сучасним комбінованим радикальним лікуванням, немає реальних даних відносно частоти рецидивів та ускладнень хірургічного лікування.
За вибірковими даними такі наслідки операцій, як парез гортані та гіпокальціємія, спостерігаються в 5-10 разів частіше, ніж у спеціалізованих клініках світу, а повторні втручання внаслідок нерадикального первинного лікування не аналізуються через відсутність послідовності спостереження пацієнтів. Лікування починається невчасно через недосконалу діагностику, недостатнє впровадження точних морфологічних методів – тонкоголкової аспіраційної пункційної біопсії та інтраопераційної експрес-біопсії. Імуноцитохімічні маркери РЩЗ майже не доступні, а гормональні маркери (кальцитонін крові, ТГ) визначаються лише в окремих лабораторіях країни. В Україні не існує жодної лабораторії з генетичного аналізу причинних мутацій при спадкових варіантах медулярного РЩЗ, який успішно роблять у більшості країн Європи, США, Азії.
Така ситуація спричинена не лише економічними та соціальними проблемами, що спіткають наше суспільство в останнє десятиріччя. Вочевидь, що відсутність самої доктрини діагностики та лікування РЩЗ, а також системи контролю за її виконанням збільшуватиме відставання України в розв’язанні цієї медичної проблеми.
Важливими кроками на шляху стандартизації лікування тиреоїдного раку в Україні є участь у розробці та підписання делегатами від України – фахівцями Українського науково-практичного центру ендокринної хірургії С.М. Черенько та О.С. Ларіним – загальноєвропейського консенсусу щодо діагностики та лікування РЩЗ. Цей протокол-керівництво було опубліковано в червні цього року в Європейському журналі ендокринології, він безкоштовно доступний в мережі Інтернет. Ми сподіваємося, що Українська асоціація ендокринних хірургів, готовність до створення якої було проголошено на останньому симпозіумі з питань ендокринної хірургії, організованому нашим центром у Києві в жовтні 2006 р., стане провідником усіх передових ідей відносно допомоги хворим на РЩЗ, сприятиме дотриманню високих вимог до якості хірургічного та комбінованого лікування пацієнтів.
- Категорії статей
- Інвалідність
- Інфекційні захворювання
- Акушерство, гінекологія, репродуктивна медицина
- Алергія
- Варікоз
- Гастроентерологія
- Гепатологія
- Головний біль
- Депресія. Психотерапія
- Дерматокосметологія
- Дитяча і підліткова гінекологія
- Дитяче харчування
- Ендокринологія. Цукровий діабет
- Кардіологія
- Мамологія
- Надлишкова вага. Дієти
- Неврологія
- Онкологія
- Отоларингологія
- Офтальмологія
- Проктологія
- Пульмонологія, фтизіатрія
- Стоматологія. Захворювання порожнини рота
- Травматологія і ортопедія
- Урологія і нефрологія
- Школа здоров'я
- Щеплення



 Торемифен — препарат выбора при блокировании рецепторного звена в антиэстрогенной терапии рака молочной железы
Торемифен — препарат выбора при блокировании рецепторного звена в антиэстрогенной терапии рака молочной железы
 Как уберечь себя от рака молочной железы
Как уберечь себя от рака молочной железы
 Терапия хронического болевого синдрома в онкологии методом химического нейролизиса
Терапия хронического болевого синдрома в онкологии методом химического нейролизиса
 Рак легких: симптомы и методы лечения
Рак легких: симптомы и методы лечения